[摘要]2013年2月啟動的仿制藥質量一致性評價工作是國家食品藥品監(jiān)督管理總局(CFDA) 為執(zhí)行國家藥品安全“十二五”規(guī)劃而開展的一項重要工作。從啟動至今,工作已經取得了一些進展,但仍存在忽視藥品質量體系的重要性、缺乏法定參比制劑、將體外溶出作為主要評價方法等3大問題,若不能妥善解決,將無法達到“十二五”規(guī)劃所設定的目標,也會給公眾用藥帶來安全隱患,給我國政府在民生保障方面的聲譽帶來負面影響,使醫(yī)療制度改革更為困難。本報告根據(jù)我國國情,參考了國際上仿制藥質量評價技術先進國家的做法,提出了解決2個問題的2項具體建議:①與國家修改《藥品管理法》修訂工作并軌,先完善目前的立法缺失,將相關重要概念定義( 如參比制劑、仿制藥) 以及仿制藥一致性評價的關鍵原則和要求規(guī)定在《藥品管理法》中,其后修改評價工作的現(xiàn)行方案。②如上述最優(yōu)路徑難以落實,則由CFDA出臺部門規(guī)章,逐步建立法定參比制劑體系,明確目前仿制藥一致性評價工作的分步實施辦法。上述改進路徑將保證評價體系科學完整,它既可以保證我國百姓能用上安全有效且質量可控的原研及仿制藥品,又將推動我國制藥產業(yè)在國際化發(fā)展機遇中整體升級并最終占領國際市場。
[關鍵詞] 仿制藥; 質量評價; 體外溶出曲線; 生物豁免
1現(xiàn)行仿制藥質量一致性評價工作方案和技術策略
1. 1仿制藥質量一致性評價辦公室已正式發(fā)布的信息 我們從中國食品藥品檢定研究院的二級網(wǎng)站仿制藥質量一致性評價辦公室官網(wǎng)檢索到以下正式公開發(fā)布的關于仿制藥質量一致性評價工作的相關信息:① CFDA辦公廳關于2013年度仿制藥質量一致性評價方法研究任務的通知( 食藥監(jiān)辦藥化管[2013]38號) ,部署國內藥品檢定機構就75個口服固體制劑體外溶出方法開展研究,以用于一致性評價。② 《仿 制 藥 質 量 一 致 性 評 價 工 作 方 案》。③ 《口服固體制劑參比制劑確立原則( 草案)》和《普通口服固體制劑溶出曲線測定與比較指導原則( 草案)》。④ 5個藥品: 鹽酸氨溴索片、鹽酸特拉唑嗪片、鹽酸奈韋拉平片、頭孢呋辛酯片、酒石酸美托洛 爾 片 的溶 出 曲 線 一 致 性 評 價 方 法 ( 草案)[1].
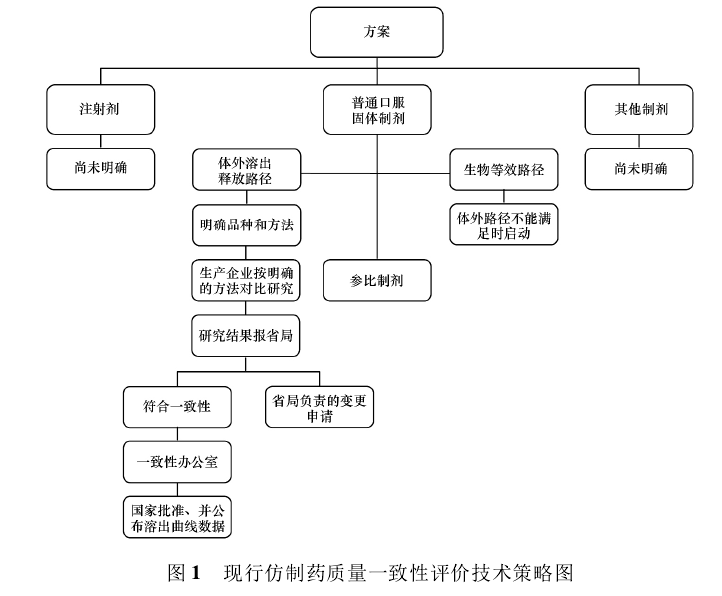
1. 2現(xiàn)已形成的技術策略 綜合現(xiàn)已發(fā)布的信息,匯總形成以下技術策略圖,見圖1.
技術策略以文字概括如下: 以常規(guī)口服固體制劑啟動此項工作。將藥品的體外溶出曲線的比較作為我國仿制藥質量一致性評價的主要方法( 也是目前看到發(fā)布的唯一方法) ,被評價的仿制藥將與參比制劑進行溶出曲線的比較。其中參比制劑以企業(yè)“自主申請-專家評估-行政批準”的方式產生。藥品檢定機構負責體外溶出的方法學研究。
2現(xiàn)行方案和技術策略的國際比較分析
2. 1仿制藥在我國法律、法規(guī)和規(guī)章上的定義及產生的影響 我國制藥行業(yè)的發(fā)展是從仿制歐美國家已經上市的藥品起步的。受此歷史起點的客觀影響,新藥和仿制藥的法律定義中的判斷原則是有無在我國上市和藥品標準有無收入藥典。二者的定義1①專利情況。②新藥的臨床研究數(shù)據(jù)是支持這一新藥安全、有效的直接證據(jù),而保證后續(xù)的仿制藥與這一新藥具有相同的有效性和安全性的關鍵是使仿制藥與這一新藥的臨床數(shù)據(jù)建立連接。由于專利的因素未在考慮范圍之內,沒有建立專利連接制度,致使生產上市的新藥不具有獨占性。同一化合物只要未在中國上市,在法律上多家申請人都有潛在獲準新藥上市的權利。盡管藥品標準與藥品質量存在一定聯(lián)系,但由于僅把藥品標準是否收入藥典作為仿制藥定義中的基本原則,而未考慮前述第2條因素,致使上市的仿制藥僅在藥品標準層面與藥典標準保持了一致,而在法律制度層面缺乏強制性規(guī)定保障全程質量控制與管理、安全性和有效性方面與已經上市的新藥( 可能是唯一的,也可能是多家) 一致以及實踐中仿制藥與新藥的臨床數(shù)據(jù)的連接。
2. 2仿制藥一致性的內涵 在教育公眾接受仿制藥、增加藥物可及性、降低藥品支付負擔時,世界衛(wèi)生組織(WHO) 對仿制藥的描述為: 仿制藥是可與原研藥相互替換的藥品,一般而言,在原研藥的專利過期或市場獨占期結束后,仿制藥廠即可在不經原研藥廠許可的條件下生產[2].
美國FDA頒布的《橙皮書》是國際公認的一本法規(guī)科學專論[2].這本1979年具有雛形、歷經34版的專論主要用來頒布經FDA批準的、與原研產品具有一致性的產品目錄。這本專論引入藥學等效和治療等效這2個概念來具體闡述一致性的內涵。藥學等效必須滿足以下條件: 仿制藥與原研藥具有相同的活性成分,并且與原研藥在劑型、劑量、規(guī)格、使用途徑等方面相同; 治療等效必須滿足以下條件: 首先滿足藥學等效,且治療與原研藥的說明書相同的適應癥人群時具有一樣的臨床安全性和有效性[2].FDA在《橙皮書》中規(guī)定,治療相等的仿制藥要滿足以下5條總體原則:①與原研產品具有一樣的安全性和有效性。②藥學等效。③生物等效( 且藥品本身不存在生物等效實驗方法學的問題,或雖有問題但不影響生物等效的結果判定)。④適當?shù)恼f明書。⑤按照c GMP的要求組織生產[2].這5層含義目前是國際上公認的仿制藥一致性的構成因素(c GMP1PIC/s,以下簡稱“五層一致性要件”)。目前,無論是WHO的藥品采購,還是國際上跨國產品認證,以及我國民族制藥企業(yè)在北美和歐洲申請仿制藥的注冊上市,均是按照這“五層一致性要件”操作執(zhí)行的。
2. 3仿制藥一致性的標準---參比制劑 仿制藥藥學等效及治療等效的標準( 即參比制劑) 應當是首個上市擁有完整臨床數(shù)據(jù)鏈的新藥。在美國,這個確立唯一的法定參比制劑(reference listed drug)的環(huán)節(jié)被以法律的形式加以規(guī)定并被明確寫入《橙皮書》。在歐盟,確定法定參比制劑的環(huán)節(jié)也是以歐盟立法的形式加以規(guī)定,即被仿制的藥品必須是成員國內已經上市8年以上的某個具體藥品,并已無市場專屬期和數(shù)據(jù)保護期。在澳大利亞,這個確定法定參比制劑的環(huán)節(jié)也被法律規(guī)定,并指向澳洲藥品注冊集(ARTG)。遺憾的是,目前我國的法律沒有明確規(guī)定仿制藥的參比制劑,更沒有將第一個批準上市的新藥作為唯一參比制劑。現(xiàn)行法律對參比制劑規(guī)定的不足導致了目前已上市的18萬個藥品批準文號在法律上各自獨立,文號所記載產品只與申請人有法律關系,文號所載同一品種的產品之間( 相同化合物) 不具有任何的法律和科學數(shù)據(jù)的關聯(lián)性。法律只規(guī)定這些文號所記載產品的標準必須符合國家標準。同時,以這些標準派生出新的仿制藥也將是合法的。這一復雜的現(xiàn)實,給本次仿制藥質量一致性評價工作提出了艱巨的法律、科學、市場競爭、監(jiān)管操作、國家影響等多方面的挑戰(zhàn)。
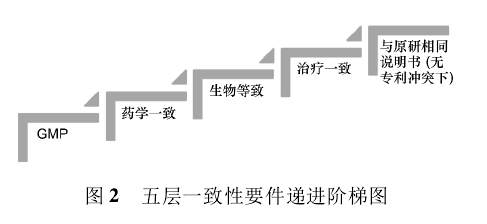
2. 4驗證一致性的技術路徑及免除生物等效性 前述五層一致性要件可以按圖2的遞進階梯圖表呈現(xiàn)。
首先,應是以GMP為代表的一系列與藥品、輔料、制劑的制備、合成、放大等生產、驗證、質控及放行方面合規(guī)性的一致性。其后,是制劑在處方、劑型、規(guī)格、劑量的藥學一致。再后,是以生物等效去驗證。經過驗證的在生物等效方法學上無技術問題或雖有問題但不影響結論的判定為治療等效。最后,使用適當?shù)恼f明書達到與原研產品在治療上可相互替換。不同國家和地區(qū)的藥品監(jiān)管立法雖有不同,但都將前述五層一致性要件作為技術策略的核心。
技術策略中的生物等效性試驗是把仿制藥的藥學一致( 質量) 和治療一致( 有效和安全) 與原研產品建立連接的關鍵( 生物等效試驗的參比制劑必須是法律規(guī)定的、有臨床安全有效數(shù)據(jù)支持的原研新藥) ,因此它也是核心中的核心。美國FDA官員余煊強博士[3]在《中國處方藥》雜志撰文這樣評述,美國仿制藥市場準入的法規(guī)路徑ANDA所基于的是2個假設:①生物等效性是藥品安全性和有效性的一個良好的替代指標。②在健康人群中取得的生物等效性研究數(shù)據(jù)對患者是等同的。為保證不同化合物特性、不同人體吸收代謝、不同治療窗的藥品的這一關鍵連接的科學可靠,截至2014年4月美國FDA先后發(fā)布了1 000多個不同品種的生物等效性試驗方法( 見圖3)[4].
不僅美國如此,其他藥品監(jiān)管制度發(fā)達的國家和地區(qū)都無一例外地采用生物等效性試驗作為連接藥學一致和治療一致的“Linker”.截至目前,本研究未發(fā)現(xiàn)任何國家或地區(qū)的監(jiān)管機構推薦使用體外溶出曲線比較的方法作為這個關鍵的“Lin-ker”.不可 否 認,近 年 來 生 物 制 劑 學 分 類 系 統(tǒng)(biopharmaceutics classification system,BCS) 概 念的引入和技術的進步,也引發(fā)技術策略上的一些新的探索。這些探索主要聚焦在通過大量的文獻和試驗研究全面分析并把握原料藥的溶解性、人體內的滲透性、藥動學、藥物的治療窗、藥物的治療領域、輔料的相互作用等信息,提出哪些藥物可以在技術策略上免除生物等效性試驗,而以體外溶出曲線代替。受WHO的委托,國際藥劑師聯(lián)盟(FIP) 聯(lián)合相關的學術機構在此領域做了大量的工作并在其網(wǎng)站公開發(fā)布了專論(monographs)。截至2014年4月,已發(fā)布專論41篇。表1列出了FIP向WHO和相應監(jiān)管機構建議的可考慮免除生物等效性研究而通過體外溶出來驗證一致性的品種目錄[5].
值得注意的是,這41個品種是FIP和頂尖學術機構在通過大量的試驗和文獻對比研究中謹慎確定的,且它們僅作為技術策略中的極少數(shù)例外,而生物等效性試驗仍然是國際公認的驗證仿制藥一致性的普遍科學手段中的關鍵。
本次仿制藥質量一致性評價技術策略圖顯示( 見圖1) ,本次普通口服固體制劑將主要以體外實驗的方法完成。從目前唯一發(fā)布的技術指導原則《普通口服固體制劑溶出曲線測定與比較指導原則( 草案)》來看,體外方法應該是指制劑的溶出曲線。本次仿制藥質量一致性評價的技術策略把生物豁免的例外情況作為一般規(guī)則,直接以體外溶出作為Linker是缺乏科學證據(jù)支持的。但是,我們遺憾地看到,CFDA以食藥監(jiān)辦藥化管[2013]38號文的方式向各省藥監(jiān)局和中國食品藥品檢定研究院下達了任務通知,要求對以下75個藥品率先完成體外溶出方法學的研究。我們將CFDA第1期發(fā)布的要求各藥檢院( 所) 以體外溶出方法進行評價的品種目錄與上述FIP目錄進行了對比,發(fā)現(xiàn)2份目錄中僅有14個品種重疊。重疊品種目錄見表2.
2. 5國際對比分析 通過以上分析,對本次仿制藥質量一致性評價工作采取的技術策略與國際遵循的技術策略對比見表3.
3現(xiàn)行方案和技術策略面臨的風險分析
歐美建立現(xiàn)代藥品監(jiān)管制度經歷了近百年的發(fā)展歷程。藥品監(jiān)管立法、制度和社會管控機制十分復雜。全球化進程使藥品的研發(fā)和生產布局形成了復雜的全球供應鏈和監(jiān)管鏈。同時,不同制度體制下的患者對用藥安全性、有效性的基本需求又有高度的同質性( 特別是仿制藥) ,這促使了全球藥品監(jiān)管( 特別是仿制藥的監(jiān)管) 正在走向整合趨同的方向。十八大后,我國政府進一步堅定改革的決心和信心。當前,中國已成為全球第二大經濟體、第三大醫(yī)藥市場,改變藥品安全形勢已成為社會和政府的共識。但是,我們有理由擔心如果繼續(xù)按照現(xiàn)行的方案和技術策略推進仿制藥質量一致性評價工作,可能會給未來醫(yī)藥健康領域的改革與立法帶來困難,給公眾健康帶來危機,有可能阻礙中國制藥行業(yè)發(fā)展和國際化進程。
3. 1對《藥品管理法》修訂工作的潛在影響《藥品管理法》修訂已經進入納入立法計劃,并已經進入實施階段。如前述分析,立法層面的仿制藥指向而非原研新藥指向是造成仿制藥不具備治療等效和可替代性的根本。徹底解決這一問題需要通過法律的修訂和完善。為此,有理由相信伴隨未來市場秩序的完善和醫(yī)藥經濟的發(fā)展,作為世貿成員國的我國在本次《藥品管理法》的修訂工作中會逐步思考和建立起創(chuàng)新與發(fā)展的法律制度,逐步由現(xiàn)行的以是否有國家標準劃分新藥和仿制藥,轉變?yōu)榕c國際接軌的知識產權和臨床安全有效數(shù)據(jù)來劃分新藥和仿制藥。而本次仿制藥質量一致性評價工作以企業(yè)自主報名、工作組和/或專家組評議這種行政行為的方法確立參比制劑以解決歷史遺留問題,反而會給現(xiàn)行市場秩序和未來立法改革帶來障礙。在具體的評價方法學上,以體外溶出而非國際共識的生物等效來開展,也會造成不容低估的國際負面影響。
3. 2對協(xié)調現(xiàn)行部門間政策和相關改革措施帶來困難 醫(yī)療制度、藥品管理制度和醫(yī)改是各國政府公認的最為復雜的社會公眾健康管理事務。目前涉及醫(yī)改的有中華人民共和國國家發(fā)展和改革委員會、中華人民共和國國家衛(wèi)生和計劃生育委員會、中華人民共和國人力資源和社會保障部、CFDA等十幾個部門。各部委依據(jù)其職能分頭管理藥品價格、基本醫(yī)療保險目錄、基本藥物目錄、藥品招標投標等領域的社會健康管理事務。而目前仿制藥質量一致性評價工作方案看不出有任何與這些部門的工作銜接。客觀上,CFDA所確認的參比制劑、仿制藥、質量一致的仿制藥、質量不一致的仿制藥的任何變化,都會影響到其他部委的工作及其已制定和在制定的政策。在缺乏前述法律基礎、國際技術策略基礎及國內職能部門聯(lián)動的基礎上推進,會對CFDA及其他部門帶來風險。
3. 3與國際先進監(jiān)管實踐的差異 國務院頒布“藥品安全規(guī)劃”的明確目標是“十二五”末藥品安全與國際接軌。而落實此規(guī)劃的現(xiàn)行仿制藥質量一致性工作方案和技術策略還缺乏與當前國際接軌的技術體系支持: 除前述法規(guī)層面的若干定義和概念的差異以及技術路徑的差異外,在科學層面( 技術指南體系) 繼續(xù)按照現(xiàn)行方案和技術策略推進工作也存在著風險和困難。圍繞仿制藥的國際注冊或質量管控,目前國際公認的技術體系有2個,一是ICH,二是WHO的預認證體系。ICH是20世紀90年代初由歐、美、日3國和地區(qū)的制藥業(yè)協(xié)會和監(jiān)管部門共同組成的國際人用藥物協(xié)調機制。這一協(xié)調機制共同制定了藥品市場準入所遵循的科學標準,分別以ICH頒布的Q/S /E /M 4個系列的指導原則為技術標準。我國目前還未全面借鑒ICH制定的有關NDA的注冊技術要求。此外,我國當前的仿制藥注冊路徑和質量管理體系與WHO的藥品全球采購預認證系統(tǒng)相比也有明顯差距。WHO等國際組織在我國進行的藥品全球采購還處于剛剛起步階段( 疫苗的預認證已經取得初步結果)。如果不盡早研究解決這一問題,而是按照現(xiàn)行的方案繼續(xù)推進,這種差異或距離會越拉越大,同時也會對WHO預認證在我國的進一步推進產生影響。
3. 4患者可能承擔的風險 如果仿制藥一致性評價工作無法有效地篩查出安全有效性不達標的仿制藥并強制其退出市場,那么我國患者將承擔多方面風險。首先,患者服用了療效不達標甚至沒有療效的仿制藥之后,將無法在預計的療程內得到康復。這將延長患者的治療期,耗費患者更多的財力與精力。此外,服用療效不達標的仿制藥可能使患者錯過黃金治療期,最終影響患者的康復效果,甚至由于拖延給患者健康造成危害。再者,從患者的經濟效率角度來看,對于缺乏專業(yè)知識的普通患者而言,很難能從眾多宣稱具有相同功效的產品中選擇出真正可以治療自己疾病的藥品( 醫(yī)生也同樣面臨這一選擇成本)。由于質量不達標的仿制藥往往是由于其生產工藝落后并使用了低成本的原材料,獲得更多的市場競爭優(yōu)勢,從而出現(xiàn)“劣幣驅逐良幣”效應,從長期來看,將對我國患者獲得有效治療產生不利影響。
3. 5制藥行業(yè)可能面臨的風險 仿制藥一致性評價工作的結果也將深刻影響我國醫(yī)藥行業(yè)的未來發(fā)展。如前所述,醫(yī)生與患者從長期的用藥經驗中會逐漸識別出安全有效性不達標的仿制藥,并因此對國產藥品失去信心,從而對制藥行業(yè)失去信心。一旦發(fā)生了這一結果,要逐漸恢復民眾信心,需要本土企業(yè)花費更多的時間、金錢與精力,如今的國產乳制品行業(yè)就是一個很好的例證。其次,如前分析,在現(xiàn)有的定價與招標體制下,安全有效性不達標的仿制藥的存在會逐漸將質量優(yōu)良的同類藥品驅逐出市場,反而是低成本與價格才是競爭的王道。這與我國乃至世界范圍內醫(yī)藥行業(yè)倡導的大力研發(fā)與提高產品質量是背道而馳的。再者,我國醫(yī)藥行業(yè)發(fā)展的終極目標是“Made in China,For China;Made inChina,For World”.而這一目標的實現(xiàn),不但需要提高我國制藥企業(yè)的研發(fā)能力,而且需要大大提高我國仿制藥的生產質量,以達到國際先進水平,從而能夠真正被世界其他國家患者與醫(yī)生認可和接納。正如“藥品安全規(guī)劃”中所倡導的目標,即“全部化學藥品、生物制品標準達到或接近國際標準,中藥標準主導國際標準制定”.
4針對仿制藥質量一致性評價項目的行業(yè)建議
由以上對我國仿制藥一致性評價工作的分析可以看出,我國應當對現(xiàn)行方案與技術策略進行及時的調整與改進,從而更為科學有效地開展評價工作。對現(xiàn)行方案與技術策略的調整與改進,我們建議可以嘗試以下最優(yōu)改進路徑。倘若采取最優(yōu)改進路徑會遭遇不可克服的阻力,可嘗試次優(yōu)改進路徑。
4. 1最優(yōu)改進路徑---修改《藥品管理法》中的仿制藥的規(guī)定 建議與《藥品管理法》的修訂工作并軌,完善目前的立法缺失后再行制定此項工作的整體的實施方案。基于前述分析,由于現(xiàn)行法律制度對仿制藥規(guī)定的不完善,使得一致性評價工作的實施缺少具體的法律依據(jù)。如果先于法律規(guī)定制定一致性評價的具體要求,則可能會與日后的法律修訂或新法出臺形成沖突。因此,我們建議,可借助目前國家正在修訂《藥品管理法》的時機,將仿制藥的重要概念定義( 如仿制藥、被仿制藥等) 與一致性評價的原則與具體要求規(guī)定在《藥品管理法》這一藥事方面最高效力的法律中。其后,再依據(jù)這些規(guī)定制定一致性評價工作的整體實施方案,逐步建立法定參比制劑體系。這樣既為此工作奠定了法律基礎,符合“依法治國”的方針政策,同時也避免了工作方案與日后的修法沖突的尷尬局面。此外,我們認為,盡管《藥品管理法》的修訂工作會使一致性評價工作延后開展,但這并不影響“藥品安全規(guī)劃”的實施,因為一致性評價工作僅僅是規(guī)劃中的一部分。一部分未達成并不影響整體規(guī)劃的實施效果。
4. 2次優(yōu)改進路徑---修改部門規(guī)章中的仿制藥規(guī)定 如難以與《藥品管理法》的修訂工作并軌,應由相關規(guī)劃實施部門出臺部門規(guī)章,明確分步實施的過程。考慮到《藥品管理法》的修訂可能涉及多個部門與領域的協(xié)調,如果第一種路徑行不通,可以嘗試由相關規(guī)劃實施部門( 主要是CFDA) 出臺專門規(guī)范一致性評價工作的全面系統(tǒng)的部門規(guī)章,規(guī)定一致性評價的基本原理與具體要求。基于本報告前文對歐盟、美國與日本成功經驗的介紹及對我國現(xiàn)狀的認識,建議國家可以考慮對一致性評價工作分步進行。亦即,部門規(guī)章可以規(guī)定首先進行以GMP軟件系統(tǒng)為主的質量體系一致性評價,從而淘汰一部分軟件系統(tǒng)不合格的仿制藥產品; 其次進行以體外溶出為主的藥學一致性評價,再淘汰一批藥學不達標的仿制藥產品; 最后進行生物一致性評價,最終淘汰一批仿制藥產品。三輪一致性評價都達標的產品才被認定為與被仿制藥一致。這一路徑的一大優(yōu)1低,因為從前一輪淘汰的產品將不再進入第二輪評價,避免了重復評價。
4. 3對我國制藥產業(yè)整體升級的重大意義 我國制藥產業(yè)目前面臨的主要瓶頸是自主研發(fā)能力薄弱、缺乏原研藥產品。這一瓶頸的突破需要長期、持續(xù)、大量的研發(fā)經費與人才投入,非一朝一夕所能達成。而我國制藥產業(yè)在中短期可以治理的問題是:我國仿制藥產品質量參差不齊,產能過剩,競爭過度而利潤率低下。被過度競爭擠壓的利潤空間以及較低的監(jiān)管要求更適合眾多中小型仿制藥企業(yè)以低價沖擊市場的策略,而致力于發(fā)展高質量仿制藥產品的現(xiàn)代化企業(yè)在低技術含量的價格戰(zhàn)中處于劣勢,最終造成小企業(yè)驅逐大企業(yè)的市場怪象。
根據(jù)資料顯示,目前全球仿制藥市場的規(guī)模達800億美元,并以8%的速度增長,而中國仿制藥行業(yè)增長速度為25% .從2012年1月1日起至2016年12月31日的5年間,全球將有多達631個專利藥到期。與此同時,分析報告顯示,中國醫(yī)藥市場發(fā)展?jié)摿薮螅?015年中國將成為全球第二大醫(yī)藥市場國家[6].這些數(shù)據(jù)預示著中國仿制藥產業(yè)正迎來一個前所未有的發(fā)展機遇。我國政府與企業(yè)應把握這一歷史機遇,科學有效地開展一致性評價工作,從而推進產業(yè)升級。
對現(xiàn)行方案與技術策略的前述調整與改進將幫助我國科學有效地開展一致性評價工作,通過實施國際通行的技術策略,實現(xiàn)我國仿制藥質量與國際標準接軌。這一政策調整的連鎖效應將是巨大的。從國內來看,這將科學合理地淘汰一批質量低下、重復率高的仿制藥,逐步提高仿制藥市場集中度,恢復仿制藥產品的合理利潤空間,讓致力于發(fā)展高質量仿制藥產品的企業(yè)將在良性競爭中取勝,從而做大做強,進一步提升自己的研發(fā)能力。同時,高質量仿制藥產品將憑借價廉優(yōu)質爭奪原研藥的市場份額,有利于更多患者獲得有效治療,減少醫(yī)藥開銷并更好地節(jié)省醫(yī)保費用支出。從國際來看,通過實施國際通行的注冊技術要求與質量控制標準,將最大限度地幫助我國仿制藥企業(yè)走出國門,邁入國際市場。華海藥業(yè)、海正藥業(yè)等若干國內領先的制藥企業(yè)已經通過商業(yè)實踐向眾多國內制藥企業(yè)證明了這一路徑的可行性與重要性。它們通過不斷提升產品質量達到國際先進水平,并獲得美國FDA與其他國家監(jiān)管部門的認證與批文,已經從以原料藥出口為主成功轉型為以仿制藥制劑出口為主,從價值鏈低端逐漸向價值鏈高端攀升,這也將幫助我國從一個仿制藥大國更快地轉型為仿制藥強國。
5結語
歷史發(fā)展進程中基于認知的局限以及基于客觀進程所遺留問題的解決不可能一蹴而就。FDA在其2014年頒布的第34版《橙皮書》中仍然明確闡明法律所認定的可作為被仿制的依據(jù)的藥品不包括老藥( 依據(jù)1938年前法規(guī)上市的藥品) 和僅證明安全性的藥物( 依據(jù)1962年法規(guī)上市的藥品) ,而只有1962年修法后有安全、有效的臨床證據(jù)的藥品才可作為被仿制的依據(jù)。藥品監(jiān)管是復雜的,與國家的發(fā)展歷程、社會和公眾的認知歷程、科學和技術手段的發(fā)展密切關聯(lián)。各國都在基于本國國情和社會進步尋找適合自身的解題方案。立法的修訂劃清了時代界限,科學方法的引入保證了方向正確。我們相信,憑借改革的決心和科學的態(tài)度并基于社會共識所形成的方案將是促進我國制藥行業(yè)健康高效發(fā)展、實現(xiàn)公眾用藥安全的必由之路。
本課題于2014年初正式立項,2014年8月共同完成此課題報告,先后得到有關領導和行業(yè)專家的幫助和鼓勵。特別是CFDA、中國食品藥品檢定研究院、上海市藥品檢驗所等有關領導和專家對此課題報告提出了寶貴的指導意見,為完善課題報告指明了方向。我們可喜地看到,2015年11月18日,CFDA發(fā)布了關于征求《關于開展仿制藥質量和療效一致性評價的意見( 征求意見稿)》意見的公告(2015年第231號) ,提出“原則上企業(yè)應采用體內生物等效性試驗的方法進行評價,允許企業(yè)采取體外溶出度試驗的方法進行評價。采用體外溶出度試驗方法進行評價的品種,以后還應當采取體內生物等效性試驗的方法進行后續(xù)評價”.國家藥品監(jiān)管部門正積極吸收國際經驗、堅持科學發(fā)展觀,切實地做好仿制藥質量一致性評價工作。我國也將從仿制藥大國逐步走向仿制藥強國,隨著我國藥品監(jiān)管制度的一系列改革,國家和制藥產業(yè)都將更加重視創(chuàng)新和質量,我國制藥產業(yè)正面臨全新的發(fā)展階段,我們可以相信不遠的將來我國一定能夠成為制藥強國。
[ 參 考 文 獻 ]
[1] 中國食品藥品檢定研究院仿制藥質量一致性評價辦公室。關于征求頭孢呋辛酯片、奈韋拉平片、鹽酸特拉唑嗪片、鹽酸氨溴索片、酒石酸美托洛爾片等5種藥品溶出曲線一致性評價方法( 草案) 意見的通知[EB /OL].[2014 - 02 - 21]. http:/ /www. nifdc. org. cn / fzy / CL0622 / .
[2]Food and Drug Administration Center for Drug Evaluation and Re-search Office of Medical Products and Tobacco Office of GenericDrugs,Approved drug products with therapeutic equivalence eval-uation[EB / OL].[2014 - 05 - 11]. http:/ / www. fda. gov / down-loads / Drugs / Development Approval Process / UCM071436. pdf.
[3] 余煊強。美國仿制藥的歷史演變[J].中國處方藥,2008,7(9) :47 - 49.
[4]FDA. Drug Price Competition and Patent Term Restoration Act of1984[EB / OL].[2014 - 10 - 10]. http:/ / www. fda. gov / news-events / testimony / ucm115033. htm.
[5]International Pharmaceutical Federation(FIP) ,Biowaiver Monogrphs[EB/OL].[2014 - 05 - 11]. http:/ /www. fip. org/bcs_mono-graphs.
[6] 趙婷。中國仿制藥產業(yè)迎春天 兩年后市場或達5000億[EB /OL].[2014 - 07 - 04]. http:/ / money. 163. com / special /view415 / .