摘要:【背景】肺炎鏈球菌是社區獲得性肺炎最常見(jiàn)的致病菌之一, 它也會(huì )引起腦膜炎、鼻竇炎、中耳炎、菌血癥等一系列疾病, 對人類(lèi) (特別是兒童、老人、免疫缺陷患者) 健康造成重大威脅。鐵是肺炎鏈球菌生存和感染所必需的元素之一, 其中血紅素轉運系統PiuABCD是肺炎鏈球菌最重要的鐵轉運系統。【目的】克隆, 表達和純化肺炎鏈球菌血紅素轉運系統脂蛋白piuA, 并在體外表征piuA蛋白的血紅素結合特性。【方法】將肺炎鏈球菌D39菌株中的piuA (spd1652) 基因連接到載體pBAD-His A上, 在大腸桿菌Top10菌株中進(jìn)行異源表達, 然后運用Ni-NTA親和層析純化piuA-His蛋白, 并用腸激酶切掉His標簽獲得不含標簽的piuA蛋白, 最后運用圓二色譜、紫外光譜和熒光光譜表征piuA蛋白的血紅素結合特性。【結果】構建了p BAD/His A-piuA重組表達載體, 獲得了純度大于95%的PiuA蛋白, 圓二色譜顯示piuA蛋白與Hemin結合后, 其二級結構不發(fā)生改變;紫外光譜結果顯示piuA蛋白具有血紅素結合能力;熒光光譜結果顯示apo-piuA蛋白與Hemin結合常數K=3.4×105 M-1.【結論】肺炎鏈球菌血紅素轉運系統脂蛋白piuA能夠特異地結合血紅素, 為肺炎鏈球菌的生存和感染提供必需的鐵源, piuA蛋白的體外表征結果為針對piuABCD血紅素轉運系統設計抗菌藥物奠定了基礎。
關(guān)鍵詞:肺炎鏈球菌; 血紅素結合脂蛋白PiuA; 圓二色譜; 紫外光譜; 熒光光譜;
肺炎鏈球菌是一種革蘭氏陽(yáng)性菌, 會(huì )引起肺炎、腦膜炎、鼻竇炎、中耳炎、菌血癥等一系列疾病, 對人類(lèi) (特別是兒童、老人、艾滋病患者和其他免疫缺陷患者) 健康造成重大威脅[1-2].WHO估算全球每年有至少120萬(wàn)嬰幼兒死于肺炎鏈球菌引起的疾病, 其中90%為發(fā)展中國家兒童[3-4].疫苗和抗生素是目前預防和治療肺炎鏈球菌感染疾病的主要手段。但是近年來(lái)隨著(zhù)各種抗生素在臨床上的廣泛使用以及不合理應用, 導致了細菌的抗藥性迅速提高和傳播, 耐青霉素肺炎鏈球菌 (Penicillin resistant Streptococcus pneumoniae, PRSP) 在世界范圍內廣泛傳播 (同時(shí)伴有對其他抗生素的多重耐藥) .一些地區的菌株對青霉素的耐藥率高達45%, 使得肺炎鏈球菌感染的治療面臨越來(lái)越大的困難[5].由于耐抗生素的肺炎鏈球菌的發(fā)生率越來(lái)越高, 抗菌藥的研究與開(kāi)發(fā)速度已遠遠跟不上細菌耐藥的速度, 因此迫切需要篩選新的藥物用于治療肺炎球菌感染性疾病。
在過(guò)去的10年里, 人們發(fā)現過(guò)渡金屬離子在宿主-病原體相互作用過(guò)程中發(fā)揮著(zhù)重要作用, 尤其是鐵離子作為過(guò)渡金屬對細菌的細胞生理學(xué)尤為重要[6-8].鐵是絕大多數細菌生存和感染所必需的元素, 但是宿主環(huán)境中游離存在的鐵離子非常有限 (<10 mol/L) , 所以細菌進(jìn)化出了對鐵離子具有高度親和力的鐵ABC攝取系統 (Iron ABC uptake systems) , 這些系統可直接從宿主細胞中的轉鐵蛋白、含血紅素蛋白和非血紅素含鐵蛋白中掠奪鐵離子。由于鐵ABC攝取系統在鏈球菌中具有高度的保守性, 均由類(lèi)似的蛋白 (脂蛋白、ATP結合蛋白和疏水的膜蛋白) 構成, 且其中的脂蛋白是暴露在細胞膜外的, 可以成為這些細菌引發(fā)的感染性疾病的疫苗候選物和藥物靶標[9-11].因此, 針對細菌鐵攝取系統和鐵代謝設計的抗菌藥物和疫苗也逐漸成為研究熱點(diǎn), 對解決當前耐藥菌感染和細菌耐性問(wèn)題意義重大[12-15].
肺炎鏈球菌中已知的鐵ABC攝取系統有四個(gè), 即血紅素轉運系統Piu ABCD、鐵色素轉運系統Pia ABCD、鐵離子轉運系統Pit ABCD、以及新發(fā)現的鐵轉運系統Operon 804[16-18].其中脂蛋白Piu A和Pia A存在于所有已知的肺炎鏈球菌中, 是小鼠全身和肺部感染模型中所必需的毒力因子, 用重組表達的Piu A和Pia A蛋白作為抗原免疫小鼠, 能幫助小鼠對抗侵襲性肺炎鏈球菌疾病, 因此Piu A和Pia A蛋白被認為是一種新型的有前景的肺炎鏈球菌疫苗[19-22].本實(shí)驗擬對肺炎鏈球菌血紅素轉運系統脂蛋白Piu A進(jìn)行克隆, 表達和純化, 并在體外表征Piu A蛋白的血紅素結合特性, 為針對Piu ABCD血紅素轉運系統設計抗菌藥物奠定基礎。
1 材料與方法
1.1 菌株與質(zhì)粒
肺炎鏈球菌D39 (Streptococcus pneumoniae D39) 購自美國菌種保藏中心 (American type culture collection, ATCC) ;大腸桿菌 (Escherichia coli) Top10菌株和載體PBAD/His A均購自Invitrogen公司。
1.2 主要試劑和儀器
Todd-Hewitt Broth和Yeast extract, OXOID公司;細菌DNA提取試劑盒, OMEGA公司;Prime STAR HS (Premix) 、DNA Maker、T4 DNA連接酶和各種限制性?xún)惹忻福?Ta Ka Ra公司;PCR產(chǎn)物純化回收試劑盒、膠回收試劑盒, 天根生化科技有限公司;Ni-NTA親和層析純化柱, QIAGEN公司;重組腸激酶, 中大南海海洋生物技術(shù)工程中心有限公司;L- (+) 阿拉伯糖、Hemin和氨芐青霉素, Sigma公司;小鼠His-tag單克隆抗體, 碧云天生物技術(shù)有限公司;羊抗鼠二抗, Abcam公司;ECL化學(xué)發(fā)光液, Bio-Rad公司。
普通PCR儀, Applied Biosystems公司;超聲波細胞破碎儀, 寧波新芝生物儀器公司;圓二色譜儀, 英國應用物理公司;紫外分光光度儀、Nano Drop 2000C超微量分光光度計和電感耦合等離子體質(zhì)譜儀ICP-MS, 德國Thermo公司;熒光分光光度計, 日立高新技術(shù)公司。
1.3 piu A基因的克隆和重組質(zhì)粒p BAD/His A-Piu A的構建和鑒定
根據Gen Ban K數據庫中肺炎鏈球菌D39的piu A (spd_1652) 基因序列, 利用Primer Premier 5.0設計并合成編碼去信號肽脂蛋白piu A基因的引物, piu A-F:5′-GGCGGCGAGCTCGAGACCAGTAGCTCTGCTC-3′ (黑體劃線(xiàn)部分為Sac I酶切位點(diǎn)) , piu A-R:5′-CGCCGCGAATTCTTATTTCAAAGCTTTTTG-3′ (黑體劃線(xiàn)部分為Eco R I酶切位點(diǎn)) , 以肺炎鏈球菌D39總基因組DNA為模板擴增目的基因, PCR反應體系 (100μL) :Prime STAR HS (Premix) 50μL, 引物piu A-F和piu A-R (10μmol/L) 各4μL, DNA模板 (100ng/μL) 2μL, 純水40μL.PCR反應條件:95°C 5 min;94°C 30 s, 55°C 30 s, 72°C 1 min, 30個(gè)循環(huán);72°C 10 min.
用1%瓊脂糖凝膠電泳檢測PCR產(chǎn)物, 利用膠回收試劑盒回收純化目的片段。用Sac I, Eco R I內切酶進(jìn)行雙酶切回收的目的基因片段及載體p BAD-His A, 37°C酶切4 h, T4 DNA連接酶連接目的基因和載體, 連接比例為目的基因?載體=4?1, 16°C連接過(guò)夜, 取20μL連接產(chǎn)物轉化至E.coli Top10感受態(tài)細胞, 經(jīng)氨芐青霉素抗性平板篩選陽(yáng)性重組子, 對其進(jìn)行雙酶切驗證及DNA測序驗證, 經(jīng)NCBI BLAST比對分析測序結果, 得到的正確的重組質(zhì)粒命名為p BAD/His A-Piu A.
1.4 重組蛋白Piu A-His的誘導表達和純化和不含His標簽的Piu A蛋白的獲得
將測序正確的含p BAD/His A-Piu A質(zhì)粒的Top10菌株接種于含有氨芐青霉素 (100 ng/?L) 的LB培養基中, 37°C、220 r/min振蕩培養過(guò)夜。次日將活化的菌種按1?100將菌液轉接入新鮮培養基擴大培養, 37°C、220 r/min振蕩培養至OD600=0.6-0.8時(shí), 加入L- (+) 阿拉伯糖至終濃度為0.04%, 同樣的條件繼續誘導表達4-6 h后收集菌體, 4°C、6 000 r/min離心30min, 并用1×PBS緩沖液洗滌菌體2次。將收集到的菌體于液氮和37°C反復凍融3次, 然后冰浴超聲30 min (5 s開(kāi), 5 s關(guān)) 至菌液變澄清透亮, 超聲破碎物于4°C、10 000 r/min離心30 min, 棄沉淀, 上清液用于過(guò)柱純化。
采用QIAGEN公司的Ni-NTA親和層析純化柱對重組蛋白進(jìn)行純化, 具體步驟根據說(shuō)明書(shū)所示。利用10 k D超濾管濃縮融合蛋白, 5 000 r/min, 4°C超濾至500μL, 用20 mmol/L Tris-HCl (含100 mmol/L Na Cl) 洗3次。利用重組腸激酶切掉含有6×His標簽的融合蛋白 (室溫, 16 h) .將酶切產(chǎn)物再次經(jīng)Ni-NTA柱分離, 上樣后的初次流出液即為去掉標簽的Piu A蛋白。用12%SDS-PAGE對Piu A蛋白的純度進(jìn)行檢測, 并用Western blotting對獲得的Piu A蛋白進(jìn)行鑒定。
1.5 Western blotting鑒定Piu A蛋白
分別取3μg的Piu A-His重組蛋白和不含His標簽的Piu A蛋白于12%SDS-PAGE進(jìn)行分離, 通過(guò)濕轉法將蛋白轉印至PVDF膜上, 5%脫脂奶粉封閉2 h, 按照1:1 000比例稀釋加入小鼠His-tag單克隆抗體, 或者按照1:2 000比例稀釋加入我們自己制備的小鼠Piu A多克隆抗體, 4°C孵育過(guò)夜。洗脫后加入辣根過(guò)氧化物酶 (HRP) 標記的羊抗鼠二抗, 室溫孵育1 h, 再次洗去未結合的二抗, 最后通過(guò)ECL化學(xué)發(fā)光液檢測。
1.6 Piu A蛋白的血紅素結合特性研究
1.6.1 電感耦合等離子體質(zhì)譜儀 (ICP-MS) 檢測純化的Piu A蛋白中金屬含量
純化后的Piu A蛋白用10 k D超濾管濃縮后經(jīng)BCA法測定蛋白濃度, 用超純水將蛋白樣品稀釋至5?mol/L, 在樣品中加入10?mol/L標準品銦作為內參, 送暨南大學(xué)分析測試中心, 用ICP-MS儀器測定樣品中的金屬元素含量 (Fe, Mn, Zn, Cu, In) , 每個(gè)金屬元素重復測定3次。
1.6.2 Apo-Piu A蛋白樣品的制備
純化后的Piu A蛋白溶液呈粉紅色, 經(jīng)ICP-MS測定后含有等摩爾的鐵, 后續的實(shí)驗需要用到apo-Piu A (即不含金屬元素的Piu A) , 因此我們采用鹽酸胍變性方法去除Piu A蛋白中的金屬離子并通過(guò)透析使蛋白盡可能回復到天然活性狀態(tài)。鹽酸胍在高濃度 (4-8 mol/L) 水溶液時(shí)能斷裂氫鍵, 從而使蛋白質(zhì)發(fā)生不同程度的變性, 且鹽酸胍引起的變性通常是可逆的。鹽酸胍變性具體步驟:500?L的高濃度Piu A (25?g/?L) 樣品, 加入鹽酸胍 (終濃度為8 mol/L) 至2 m L左右, 4°C處理4 h后, 加入50 mmol/L的EDTA至終濃度為25 mmol/L, 4°C過(guò)夜處理 (約12 h) .接下來(lái)先用20 mmol/L Tris-HCl緩沖液 (含10 mmol/L的EDTA和100mmol/L的Na Cl, p H 7.4) 透析一次, 然后用20 mmol/L Tris-HCl緩沖液 (含100 mmol/L的Na Cl, p H 7.4) 連續透析4次, 最后用10 k D超濾管濃縮后經(jīng)BCA法測定蛋白濃度, 將apo-Piu A蛋白樣品用超純水稀釋至5?mol/L, 利用ICP-MS儀器測定樣品中的金屬元素含量 (Fe, Mn, Zn, Cu, In) .
1.6.3 圓二色譜 (CD) 分析Pia A蛋白的二級結構
遠紫外區 (190 nm-250 nm) CD光譜主要反映蛋白質(zhì)氨基酸間肽鍵的圓二色性。二級結構不同的蛋白由于α螺旋, β折疊及無(wú)規卷曲在遠紫外區具有特征吸收峰, 在CD圖譜中呈現不同的特征譜峰。圓二色譜測定野生型蛋白Piu A, apo-Piu A及結合血紅素 (Hemin) 的Piu A (Piu A+Hemin) 的二級結構。高濃度的蛋白樣品用20 mmol/L Tris-HCl (含100 mmol/L Na Cl, p H 7.4) 緩沖液稀釋至3?mol/L的測試蛋白樣品, 樣品池為石英比色皿 (1 mm) , 測定參數如下:掃描波長(cháng)190 nm-250 nm, 掃描溫度25°C, 掃描速率100 nm/min, 帶寬1.0 nm.每次掃描重復3次, 取平均值得到平滑曲線(xiàn)即為最后的CD光譜, 扣除緩沖液背景。蛋白二級結構用CDPro軟件進(jìn)行計算。
1.6.4 紫外光譜檢測Piu A蛋白與血紅素結合情況
Apo-Piu A (50?mol/L) 與過(guò)量Hemin室溫孵育2 h后, 依次過(guò)脫鹽柱和10 k D超濾柱, 用緩沖液洗6次, 去掉不與Piu A結合以及非特異結合的Hemin, 剩下的樣品即為血紅素特異飽和的Piu A蛋白, 命名為Piu A+Hemin.用20 mmol/L Tris-HCl (p H 7.4, 含有100 mmol/L Na Cl) 緩沖液分別制備濃度均為25μmol/L Hemin溶液, apo-Piu A溶液和Piu A+Hemin溶液各500μL, 分別按照相同的參數用紫外分光光度計從200-600 nm波段進(jìn)行掃描, 每個(gè)實(shí)驗重復掃描3次。
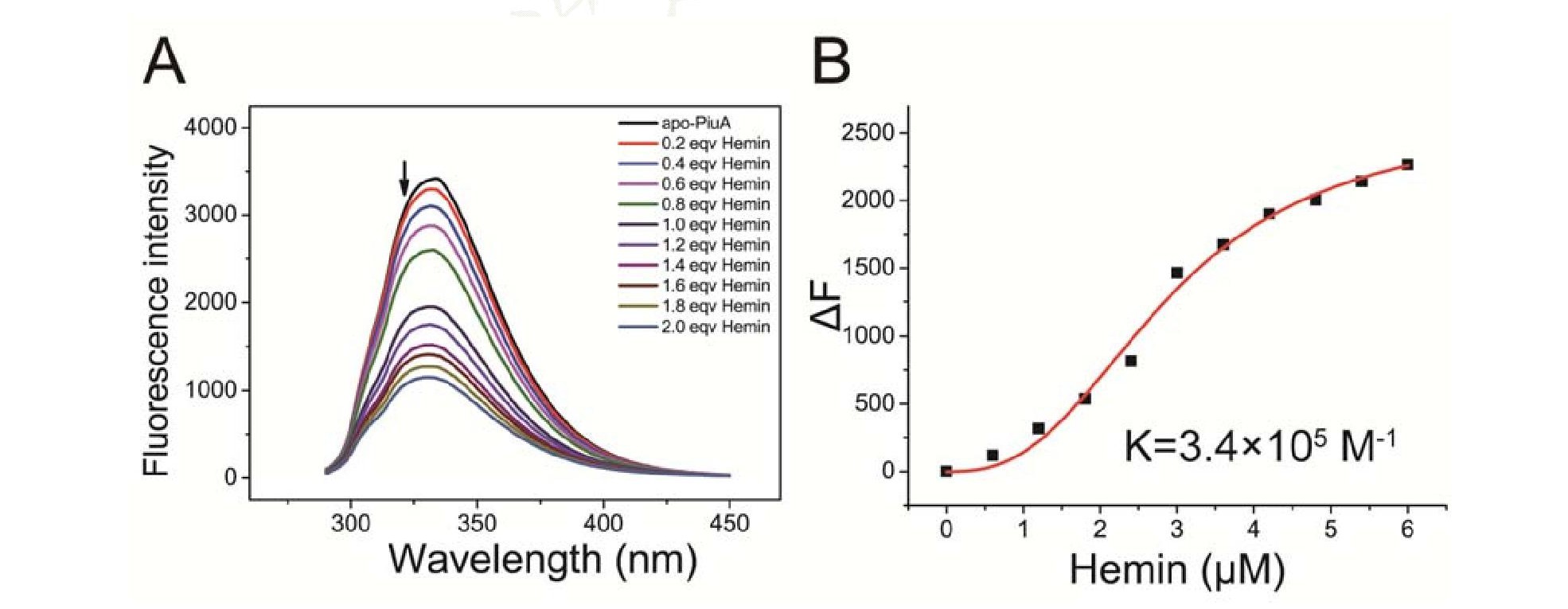
1.6.5 熒光光譜檢測Piu A蛋白與血紅素結合情況
用20 mmol/L Tris-HCl (p H 7.4, 含有100 mmol/L Na Cl) 緩沖液稀釋apo-Piu A蛋白至終濃度為3?mol/L, 用相同的緩沖液制備3 mmol/L高濃度的Hemin溶液, 依次向apo-Piu A蛋白溶液滴加0.2倍當量的Hemin溶液, 每滴加一次, 打開(kāi)磁力攪拌器攪拌5 min, 使蛋白與金屬離子反應完全, 然后掃描熒光猝滅光譜, 每次掃描均重復3次, 實(shí)驗條件和參數如下:1 cm四面透光的石英比色皿, 內有磁力攪拌子不斷攪拌, 激發(fā)波長(cháng)280 nm, 掃描范圍300-450nm, 掃描速度1 200 nm/min, 電壓530 V, 激發(fā)單元狹縫5.0 nm, 發(fā)射單元狹縫5.0 nm, 設置自動(dòng)響應時(shí)間, 水浴鍋溫度設置25°C恒溫。獲得的實(shí)驗數據用Origin 8.5軟件中的Hill方程擬合, 計算得出Piu A蛋白與Hemin的結合常數K.
2 結果與分析
2.1 重組表達載體p BAD/His A-piu A構建和鑒定
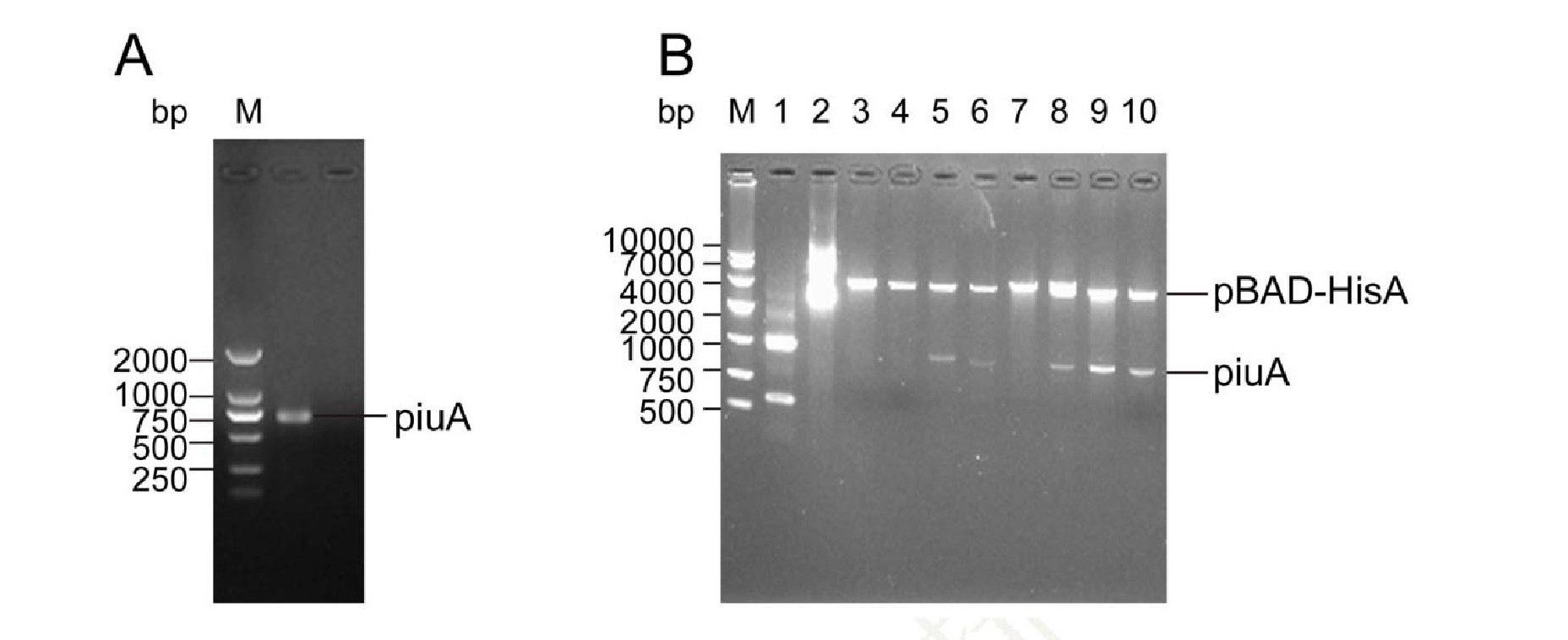
以肺炎鏈球菌D39總基因組DNA為模板, PCR反應擴增去除信號肽的piu A基因 (870 bp) , 擴增產(chǎn)物經(jīng)1%瓊脂糖凝膠驗證 (圖1A) , 與目的基因大小吻合。隨機在A(yíng)mp抗性平板上挑選8個(gè)piu A連接轉化后的克隆, 提取質(zhì)粒, Sac I, Eco R I雙酶切鑒定, 進(jìn)行1%瓊脂糖凝膠電泳, 結果有5個(gè)陽(yáng)性克隆的插入片段與與目的基因大小一致 (圖1B) .為進(jìn)一步確認重組質(zhì)粒的正確性, 將所得的陽(yáng)性克隆送Invitrogen公司測序, 測序結果經(jīng)序列比對顯示目的基因與NCBI數據庫中的肺炎鏈球菌D39的piu A基因100%匹配, 且沒(méi)有發(fā)生移碼和基因突變, 表明重組表達載體p BAD/His A-Piu A構建成功。
注:A:PCR擴增piuA基因;B:重組表達載體pB AD/HisA-PiuA雙酶切驗證。Note:A:PCR product of piuA;B:Restriction enzyme analysis recombinant plasmid pB AD/His A-PiuA with Sac I and EcoR I.
2.2 Piu A蛋白誘導表達、純化檢測和鑒定
將測序正確的含p BAD/His A-Piu A質(zhì)粒的Top10菌株接種到LB中, 經(jīng)L- (+) 阿拉伯糖誘導表達4-6 h后收集菌體, 超聲破碎裂解菌體, 裂解后的全蛋白上清液通過(guò)Ni-NTA親和層析柱純化, 用不同濃度咪唑 (10-500 mmol/L) 進(jìn)行梯度洗脫, 在50 mmol/L咪唑濃度洗脫液中能最大量收獲條帶單一的Piu A-His融合蛋白 (圖2A) , 表明Piu A-His融合蛋白是可溶性表達的。重組腸激酶能識別序列DDDDK, 將His標簽切掉, 純化后的不含His標簽的Piu A蛋白經(jīng)12%SDS-PAGE分析, 可以看出經(jīng)過(guò)純化后得到單一的Piu A (31.6 k D) 蛋白條帶 (圖2B) , 且蛋白純度在95%以上。另外由于Piu A-His融合蛋白帶有標簽蛋白His, 可與Anti-His抗體發(fā)生特異性抗原-抗體反應, 因此運用His抗體作為一抗, 進(jìn)行Western blotting檢測, 從PVDF膜上可觀(guān)察到特異的單一蛋白條帶 (圖2C) , 且分子量大小與Piu A蛋白一致;另一方面, 我們運用Piu A鼠多克隆抗體作為一抗, 進(jìn)行Western blotting檢測了Piu A-His和Piu A蛋白, 如圖2D所示, 從PVDF膜上可觀(guān)察到特異的單一蛋白條帶。以上結果表明Piu A蛋白制備成功, 可進(jìn)一步用于體外生化表征。
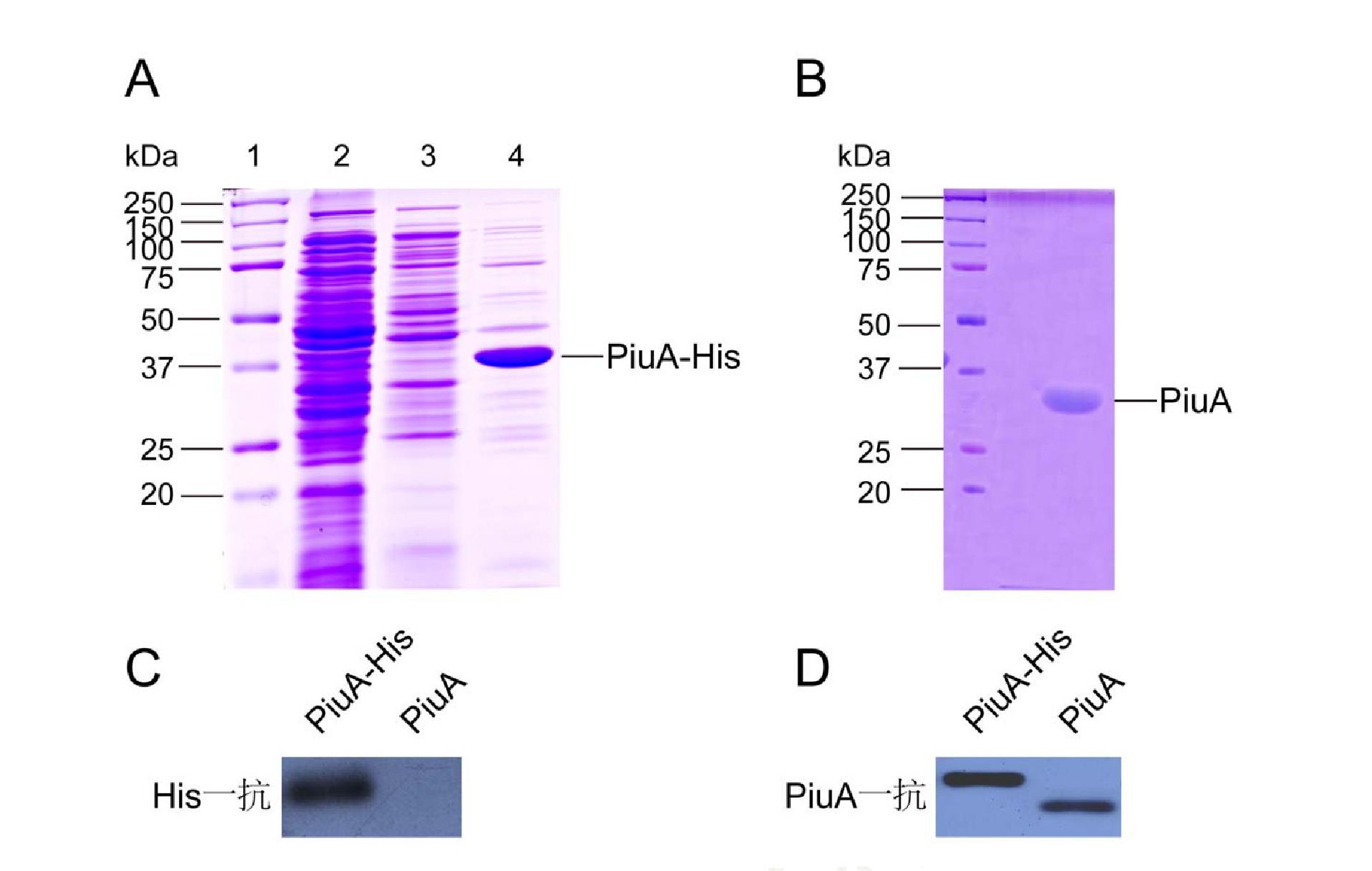
注:A:12%的SDS-PAGE檢測PiuA-His融合蛋白。1:蛋白marker;2:全蛋白上清液;3:10 mmol/L咪唑洗脫液;4:50 mmol/L咪唑洗脫液;B:12%的SDS-PAGE檢測PiuA蛋白;C:Western blotting驗證Piu A-His融合蛋白和PiuA蛋白, His抗體作為一抗;D:Western blotting驗證Piu A-His融合蛋白和PiuA蛋白, PiuA鼠多克隆抗體作為一抗。Note:A:Detection of PiuA-His fusion protein with 12%SDS-PAGE;1:Protein marker;2:whole protein supernatant;3:Proteins eluted with 10 mmol/L imidazole;4:Proteins eluted with 50 mmol/L imidazole;B:Detection of PiuA protein with 12%SDS-PAGE;C:Verification of PiuA-His fusion protein and PiuA protein by using Western blotting with His antibody;D:Verification of PiuA-His fusion protein and Piu A protein by using Western blotting with PiuA mouse polyclonal antibody.
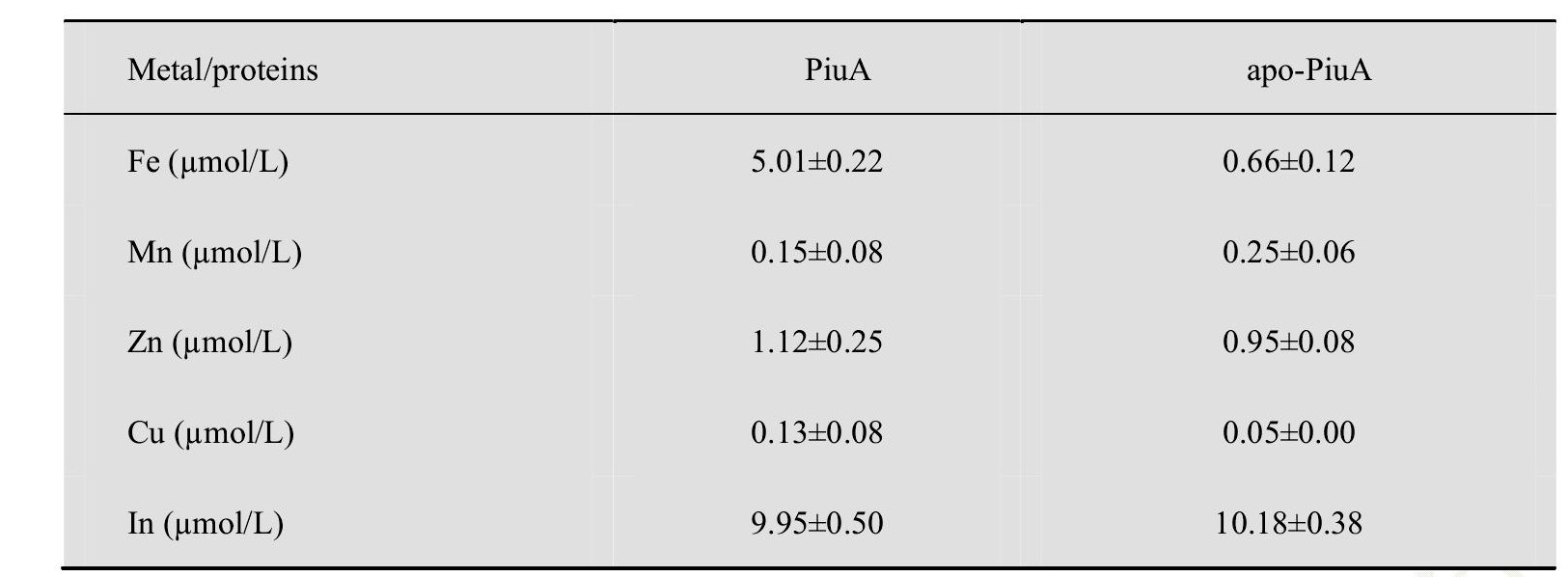
2.3 ICP-MS檢測純化的Piu A蛋白和apo-Piu A蛋白中的金屬含量
純化后的Piu A蛋白溶液呈粉紅色, ICP-MS測定結果顯示, 純化后的每個(gè)Piu A蛋白分子含有一個(gè)鐵離子, 不含其他金屬離子 (表1) .經(jīng)過(guò)摸索, 最終采用8 mol/L的鹽酸胍和25mmol/L的EDTA對Piu A蛋白進(jìn)行變性螯合出其中的血紅素, 獲得的apo-Piu A蛋白, 然后經(jīng)過(guò)48小時(shí)的透析使蛋白復性, ICP-MS測定結果顯示, apo-Piu A蛋白不含任何金屬離子 (表1) .
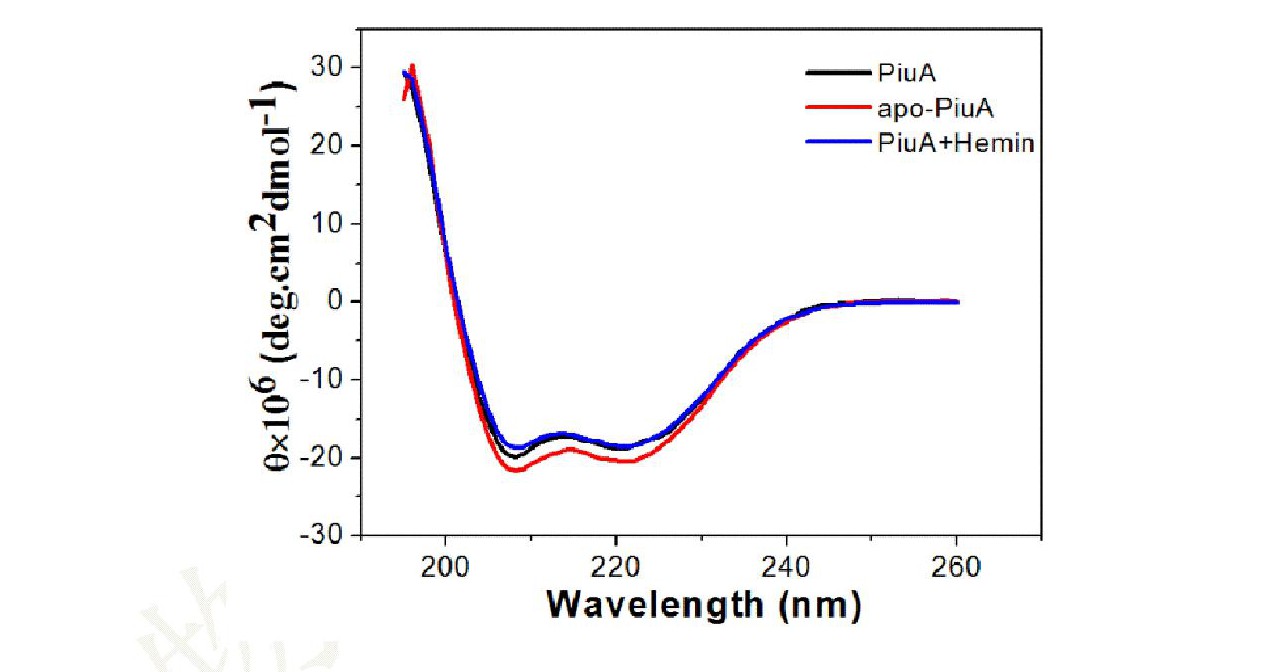
2.4 CD分析Piu A, apo-Piu A和Piu A+Hemin蛋白的二級結構
從圖3的CD圖譜得知, Piu A, apo-Piu A和Piu A+Hemin蛋白的二級結構幾乎一致, 表明采用鹽酸胍變性方法獲得的apo-Piu A蛋白通過(guò)透析的方法恢復到了天然的狀態(tài), 可用于后續的實(shí)驗。同時(shí)發(fā)現Piu A蛋白與Hemin結合后, 其二級結構幾乎不發(fā)生改變。
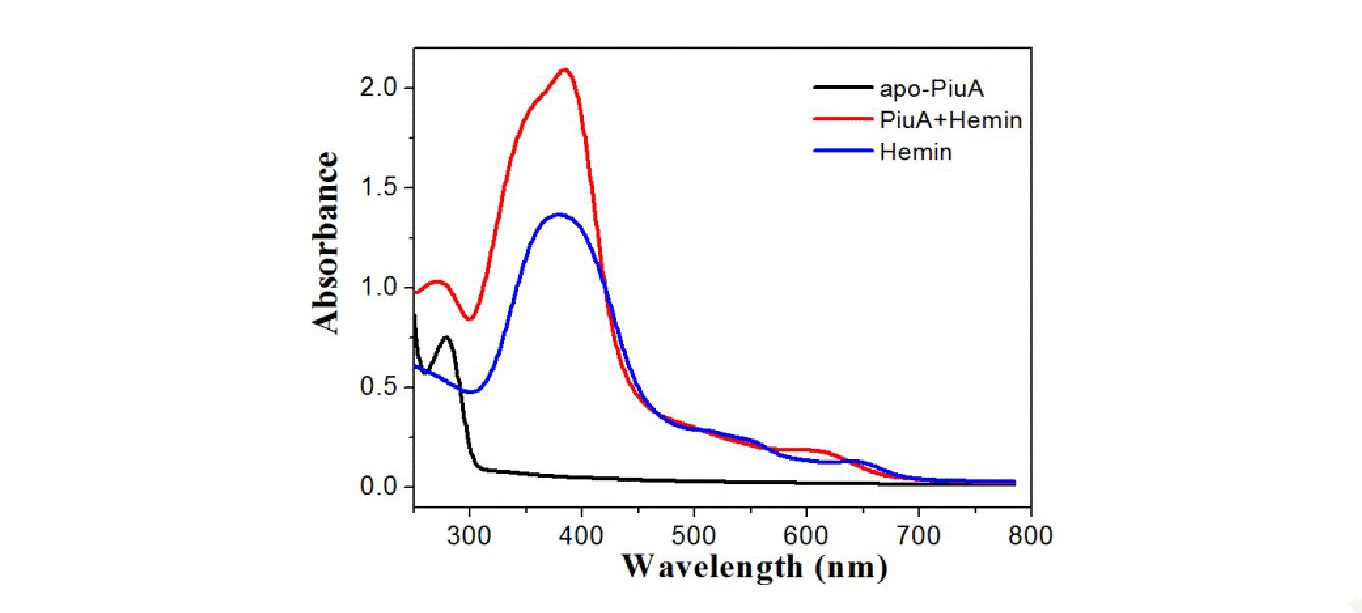
2.5 紫外光譜檢測apo-Piu A蛋白與血紅素結合情況
將30μmol/L血紅素溶液, apo-Piu A溶液和Piu A+Hemin溶液分別進(jìn)行紫外分光光度計掃描后, 紫外光譜圖4顯示apo-Piu A蛋白只在280 nm處有一蛋白特征吸收峰, Piu A+Hemin蛋白除了在280 nm的蛋白吸收峰外, 還在401 nm處有一血紅素特征吸收峰, 且與等摩爾量的Hemin的吸收峰相比, 吸收峰向長(cháng)波長(cháng)方向移動(dòng), 即有明顯的紅移 (圖4) , 表明Piu A蛋白具有血紅素結合能力。
2.6 熒光光譜檢測apo-Piu A蛋白與血紅素結合
Apo-Piu A蛋白與血紅素結合的強弱可以利用熒光光譜檢測, 向apo-Piu A蛋白溶液 (3μmol/L) 中不斷滴加高濃度Hemin, 由于apo-Piu A蛋白與Hemin結合后相互作用產(chǎn)生微環(huán)境變化從而造成電子躍遷, 然后回至基態(tài), 在333 nm處發(fā)生熒光猝滅現象 (圖5A) , 表明Hemin的結合引起了apo-Piu A蛋白空間構象的變化。根據Origin 8.5軟件中的Hill方程[y=Vmax×x/ (k+x) ]對Hemin濃度和333 nm處的絕對熒光值做曲線(xiàn)擬合, 計算得出apo-Piu A蛋白與Hemin結合常數為K=3.4×10 M (圖5B) .
3 討論與結論
鐵離子是細胞代謝過(guò)程中許多蛋白或酶的輔助因子, 主要參與電子傳遞、氧的激活、呼吸作用、過(guò)氧化氫物的還原、氨基酸和DNA的合成以及光合作用等代謝過(guò)程, 是大多數細菌生存以及形成感染的必需元素[8,23-25].肺炎鏈球菌作為當今世界范圍內引發(fā)感染和死亡的重要病原菌之一, 在感染宿主 (人) 過(guò)程中, 必須從人體獲得養分, 這其中就包括鐵、錳、鋅、銅等微量元素[6].血紅素占人體總鐵源的80%以上, 為了從人體中獲取血紅素滿(mǎn)足自身的生存和感染, 肺炎鏈球菌進(jìn)化出了血紅素攝取系統Piu ABCD.依靠該攝取系統的ATP結合蛋白Piu B提供能量, 脂蛋白Piu A作為底物結合蛋白能夠直接特異地結合血紅素, 并與膜蛋白Piu C和Piu D相互作用將血紅素釋放并轉運到肺炎鏈球菌體內。由于脂蛋白Piu A存在于所有已知的肺炎鏈球菌中, 目前已被證明是潛在的肺炎鏈球菌疫苗候選物, 但是目前對Piu A蛋白結合和釋放血紅素的過(guò)程并沒(méi)有細致深入地研究。
金屬組學(xué) (Metallomics) 是2002年逐漸發(fā)展起來(lái)一門(mén)綜合研究生命體內金屬和類(lèi)金屬元素的分布、存在的形態(tài)、屬性、含量、與其他生物大分子結合的結構及其在生物體中的生理作用和功能的學(xué)科[26], 開(kāi)展金屬組學(xué)和金屬蛋白質(zhì)組學(xué)研究將有助于認識微量元素生物效應及其機理、與微量元素相關(guān)疾病的發(fā)生機制的基礎, 同時(shí)也是金屬藥物設計的理論依據[27].目前常用的研究金屬蛋白質(zhì)體外結構與功能研究的技術(shù)主要有電感耦合等離子體質(zhì)譜儀 (ICP-MS) 、圓二色譜 (CD) 、紫外光譜、熒光光譜、停留光譜儀、等溫熱滴定儀 (ITC) 、電子順磁共振 (EPR) 、X射線(xiàn)衍射、核磁共振 (NMR) 、X射線(xiàn)吸收光譜等[27].其中ICP-MS能分析溶液中含量在ppb或者ppb以下的一系列金屬元素和B、Si、As、Te、P、Se、S等非金屬元素[27];圓二色譜 (CD) 能利用平面偏振光研究溶液中蛋白質(zhì)、DNA等生物大分子二級和三級結構和構象變化[28];由于蛋白大分子中含有具有環(huán)狀共軛體系的芳香族氨基酸, 在近紫外區190-400 nm處發(fā)生n-π電子躍遷, 產(chǎn)生紫外光譜, 同樣地, 蛋白大分子內部的芳香族氨基酸也能在氙燈光源照射下, 發(fā)生電子躍遷而產(chǎn)生熒光光譜, 因此紫外光譜和熒光光譜被廣泛應用于研究蛋白質(zhì)結構和構象、蛋白與小分子或者金屬離子的相互作用等[29,30].
本研究從肺炎鏈球菌D39基因組中克隆出piu A基因, 成功構建p BAD/His A-piu A重組表達載體, 在大腸桿菌Top10菌株中進(jìn)行異源表達, 運用Ni-NTA親和層析純化成功獲得純度大于95%的Piu A蛋白 (不含His標簽) .鹽酸胍在高濃度 (4-8 mol/L) 水溶液中能斷裂氫鍵, 從而使蛋白質(zhì)發(fā)生不同程度的變性, 且鹽酸胍引起的變性通常是可逆的, 可以通過(guò)透析的方法使蛋白恢復到天然的狀態(tài)。由于純化后的Piu A蛋白溶液呈粉紅色, ICP-MS測定結果顯示, 純化后的每個(gè)Piu A蛋白分子含有一個(gè)鐵離子, 后續的實(shí)驗需要apo-Piu A蛋白 (即不含金屬元素的Piu A蛋白) , 因此我們采用8 mol/L的鹽酸胍和25 mmol/L的EDTA去除Piu A蛋白中的血紅素從而獲得的apo-Piu A蛋白, 并通過(guò)透析的方法使其恢復到天然的狀態(tài), 用圓二色譜掃描apo-Piu A蛋白的二級結構可以看出蛋白完全恢復到天然的狀態(tài)。最后運用ICP-MS, 圓二色譜, 紫外光譜和熒光光譜手段表征了apo-Piu A蛋白與血紅素結合前后的生化性質(zhì)的變化, 實(shí)驗結果顯示Piu A能特異地結合血紅素, 結合常數K=3.4×10 M;而且Piu A蛋白與血紅素結合后, 二級結構幾乎不發(fā)生改變。此外, 后續我們將選取國內一些肺炎鏈球菌分離株進(jìn)一步研究其中的Piu A蛋白, 并比較其與參考株肺炎鏈球菌D39菌株的異同。這些結果有利于闡明脂蛋白Piu A的血紅素結合特性和機理, 為開(kāi)發(fā)針對Piu ABCD血紅素轉運系統的抗菌藥物提供了理論基礎。
參考文獻:
[1]van Der Poll T, Opal SM.Pathogenesis, treatment, and prevention of pneumococcal pneumonia[J].The Lancet, 2009, 374 (9700) :1543-1556
[2]Kadioglu A, Weiser JN, Paton JC, et al.The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease[J].Nature Reviews Microbiology, 2008, 6 (4) :288-301
[3]WHO.Pneumococcal disease.
[4]Kim GL, Seon SH, Rhee DK.Pneumonia and Streptococcus pneumoniae vaccine[J].Archives of Pharmacal Research, 2017, 40 (8) :885-893
[5]Yesilkaya H, Andisi VF, Andrew PW, et al.Streptococcus pneumoniae and reactive oxygen species:an unusual approach to living with radicals[J].Trends in Microbiology, 2013, 21 (4) :187-195
[6]Turner AG, Ong CIY, Walker MJ, et al.Transition metal homeostasis in Streptococcus pyogenes and Streptococcus pneumoniae[J].Advances in Microbial Physiology, 2017, 70:123-191
[7]Ge RG, Sun XS.Iron acquisition and regulation systems in Streptococus species[J].Metallomics, 2014, 6 (5) :996-1003
[8]Cassat JE, Skaar EP.Iron in infection and immunity[J].Cell Host&Microbe, 2013, 13 (5) :509-519