本綜述為臨床應用小檗堿與吳茱萸堿治療腫瘤與2型糖尿病提供了新的思路, 從信號通路角度討論了小檗堿與吳茱萸堿協(xié)同抗腫瘤的作用機制, 為臨床抗腫瘤治療奠定了理論基礎。
以下為本篇論文正文:
摘要:黃連-吳茱萸藥對最早出現在宋朝時(shí)期, 兩者一苦一辛, 一降一升, 對消化系統具有良好的藥理作用。現代研究表明, 該藥對對包括胃癌在內的多種腫瘤具有良好的抗腫瘤活性, 但其有效物質(zhì)基礎與協(xié)同機制尚不明確。本文總結近10年文獻, 詳細闡述了黃連-吳茱萸藥對及其主要單體間的抗腫瘤機制和協(xié)同作用機制, 文獻研究發(fā)現該藥對在治療腫瘤與2型糖尿病靶點(diǎn)通路上的共通性。本綜述為臨床應用小檗堿與吳茱萸堿治療腫瘤與2型糖尿病提供了新的思路, 從信號通路角度討論了小檗堿與吳茱萸堿協(xié)同抗腫瘤的作用機制, 為臨床抗腫瘤治療奠定了理論基礎。
關(guān)鍵詞:小檗堿; 吳茱萸堿; 抗腫瘤; 機理; 協(xié)同;
黃連-吳茱萸藥對 (簡(jiǎn)稱(chēng)“連萸藥對”) 最早見(jiàn)于宋朝《太平圣惠方》中的茱萸丸, 由黃連、吳茱萸按1:1組成, 藥對中的黃連具有清熱燥濕、瀉火解毒的功效;吳茱萸具有散寒止痛、降逆止嘔、助陽(yáng)止瀉的功效[1].兩者藥性一寒一熱, 屬寒熱配對, 彼此間功能相互協(xié)調、制約, 共同調整肝胃、肝心、脾胃等的虛實(shí)、寒熱、升降平衡[2], 常用作消化系統疾病的治療。現代研究[3]表明, 連萸藥對不僅僅局限于胃腸道疾病, 在糖尿病[4]、高血脂[5]、抑郁癥[6]、腫瘤[7]和老年性疾病[8]等的預防與治療方面的研究也有一定進(jìn)展。小檗堿 (Berberine, BBR) 又稱(chēng)黃連素, 屬于季銨型異喹啉類(lèi)生物堿, 是黃連的主要有效成分之一。吳茱萸堿 (Evodiamine, EVO) 又稱(chēng)吳茱萸胺, 為吳茱萸的有效成分之一。BBR與EVO均為生物堿成分, 展示出多種藥理活性。BBR在臨床上常用來(lái)治療腹瀉、胃腸炎等消化道疾病, 近年文獻報道其可有效治療糖尿病[9]、高脂血癥[10]等代謝性疾病, 有望對該老藥進(jìn)行二次開(kāi)發(fā)并最終用于糖尿病等的治療。EVO臨床上常用來(lái)鎮痛, 做利尿劑和發(fā)汗劑使用, 在臨床上的應用未有更多的研究報道。BBR與EVO都具有多種抗腫瘤活性, 研究者通過(guò)大鼠結腸癌模型[11]、肝癌模型[12]驗證了其抗腫瘤活性。但其作用機制仍沒(méi)有明確的概述, 本文對連萸藥對及其主要單體的抗腫瘤作用機制和靶點(diǎn)的研究現狀進(jìn)行綜述, 探索BBR與EVO的協(xié)同抗腫瘤機制, 為其臨床應用奠定基礎。
1 黃連與吳茱萸配伍研究現狀
黃連與吳茱萸配伍使用歷史悠久, 兩者配伍比例不同, 功效也不盡相同, 除經(jīng)典方茱萸丸 (連-萸1:1或3:2) 、左金丸 (連-萸6:1) 外, 通過(guò)改變其比例, 還衍生出了變通丸、抑青丸、赤龍丹 (連-萸1:1) 、甘露散 (連-萸2:1) 、反左金丸 (連-萸1:6) 、戊己丸 (連-萸-白芍6:1:6) 、二宜散 (連-萸1:2或2:1) 等方劑, 可治療多種與脾胃功能有關(guān)[13-14]的病癥, 文獻記載以左金丸與反左金丸居多[15].
1.1 連萸藥對用于胃癌的治療
連萸藥對治療胃癌的報道較為多見(jiàn)。胃癌是一種較為常見(jiàn)的消化道惡性腫瘤, 而中國是胃癌高發(fā)率及高死亡地區[16].連萸藥對治療胃癌, 其藥理活性主要體現在抑制細胞增殖和誘導細胞凋亡兩個(gè)方面。
Bcl-2超家族包括抗凋亡成員Bcl-2、Bcl-XL、Bcl-w (由BCL2L2基因編碼) 和促凋亡成員Bax、Bak、Bad等, 兩類(lèi)蛋白的表達平衡影響細胞的存亡[17].反左金丸水提物對胃癌SGC-7901細胞具有抑制增殖和誘導凋亡的作用[18].進(jìn)一步研究發(fā)現, 與反左金丸相比[19], 相同濃度的左金丸對SGC-7901細胞增殖的抑制作用更強, 凋亡特征更明顯[20].另有研究者發(fā)現, 左金方對胃癌細胞誘導凋亡的作用優(yōu)于單用黃連、吳茱萸, 可視為黃連與吳茱萸具有協(xié)同效應, 其作用主要通過(guò)下調Bax/Bcl-2比率[21]和降低細胞膜電位[22]來(lái)實(shí)現, 也可通過(guò)降低線(xiàn)粒體內跨膜電位誘導胃癌細胞凋亡, 且抑制效果強于單用黃連與吳茱萸[23].
1.2 連萸藥對用于腹水型肉瘤、結腸癌、肝癌、肺癌的治療
王曉娜等[24]對接種多藥耐藥S180腹水型肉瘤小鼠給予左金丸、黃連和吳茱萸治療7 d后, 有效降低小鼠肝指數, 升高脾指數, 延長(cháng)生存周期, 該作用左金丸組優(yōu)于黃連、吳茱萸單獨治療組。研究表明左金丸可能是通過(guò)降低多藥耐藥細胞膜上P-gp的表達, 抑制抗腫瘤藥物的外排, 從而增強抗腫瘤作用。董立等[25]在研究連萸藥對 (1:1) 水提物對二甲肼誘發(fā)的大鼠結腸上皮細胞癌的影響中發(fā)現, 藥對可以抑制結腸癌癌前病變異變腸腺病灶的形成, 并抑制二甲肼所致的結腸黏膜上皮增殖, 促進(jìn)結腸上皮細胞凋亡, 呈現出劑量依賴(lài)性, 其作用多集中于腸腺中下部, 可能具有一定的空間選擇性[26].
左金丸通過(guò)抑制轉錄激活因子 (activator protein 1, AP-1) 和核轉錄因子-κB (nuclear factor of kappa B, NF-κB) 通路從而抑制肝癌Hep G2細胞增殖[27].Xu等[28]探究左金丸對肝癌系SMMC-7721、BEL-7402、BEL-7404、Hep G2、肺癌系A549、NCI-H446、NCI-H460和結腸癌系HCT-116共八種癌細胞的作用發(fā)現, 左金丸對SMMC-7721、Hep G2和NCI-H460細胞有較好的抑制增殖作用, 可以將SMMC-7721和Hep G2細胞周期阻滯在G0/G1期, 將NCI-H460細胞周期阻滯在S期;通過(guò)免疫蛋白印跡觀(guān)察到左金丸可以上調SMMC-7721、A549和HCT-116細胞中Bax和Bak蛋白水平, 同時(shí)降低Bcl-2和Bcl-XL蛋白水平, 通過(guò)單細胞凝膠電泳結果觀(guān)測到左金丸可以激活caspase-3和caspase-9的表達從而誘導腫瘤細胞凋亡, 因而其抗癌機制可歸于線(xiàn)粒體介導的細胞凋亡途徑。
綜上, 連萸藥對可作為一種治療胃癌、腹水型肉瘤、結腸癌、肝癌、肺癌等的潛在藥物, 其抗腫瘤活性研究從胃癌開(kāi)始, 逐步擴展到其他消化系統腫瘤, 再到非消化系統腫瘤, 其潛在抗腫瘤藥理活性不斷被發(fā)掘。其作用機制可能是線(xiàn)粒體介導的細胞凋亡途徑, 通過(guò)激活Bax、Bak蛋白表達, 下調Bcl-2、Bcl-XL蛋白表達水平, 刺激caspase-3和caspase-9活性增強, 從而誘導細胞凋亡。
2 EVO與BBR抗腫瘤作用
EVO與BBR對多種腫瘤有藥理活性, 抗腫瘤機制的研究多集中在細胞學(xué)和分子學(xué)基礎上。其作用主要體現為抑制腫瘤細胞增殖、誘導凋亡和減少腫瘤的惡性轉化與轉移等方面[29].
2.1 EVO的抗腫瘤作用
NF-κB參與調節多種基因的轉錄, 如細胞周期蛋白D1 (cyclin D1) 、C-Myc、環(huán)氧化酶-2、基質(zhì)金屬蛋白酶-9、細胞間粘附分子-1、生存蛋白、凋亡抑制蛋白、Bcl-2、Bcl-XL等[30].EVO對大多數腫瘤細胞都會(huì )引起NF-κB的抑制與失活。絲氨酸/蘇氨酸激酶 (serine/threonine kinase, Akt) 是參與磷脂酰肌醇-3-羥激酶 (phosphatidylinositol 3-hydroxy kinase, PI3K) 信號傳導的主要效應分子, Akt的活化異常是各種復雜疾病 (含2型糖尿病和癌癥) 的病理生理學(xué)特性的基礎[31].
在胃癌、肝癌細胞系中, 表現為抑制細胞增殖。經(jīng)caspase抑制劑干擾, EVO仍可抑制SGC-7901細胞增殖并誘導其凋亡, 表明其除激活caspase途徑外還有其他通路可誘導細胞凋亡[32].EVO也可以通過(guò)下調Akt、低氧誘導因子、磷酸果糖激酶、PRPP合成酶和p53的表達, 影響特異糖代謝過(guò)程, 抑制肝癌Hep G2細胞增殖[33].
在乳腺癌、宮頸癌、黑色素瘤細胞系中, 機制主要是誘導細胞凋亡。EVO通過(guò)下調MMP-9, 抑制血管新生, 從而抑制人乳腺癌MDA-MB-231細胞的遷移和侵襲;進(jìn)而通過(guò)下調Bcl-2、細胞周期蛋白D1和細胞周期蛋白依賴(lài)性激酶-6的表達或上調Bax和p27的表達使細胞周期停滯在G0/G1期, 誘導細胞凋亡[34];EVO也可將人乳腺癌NCI/ADR-RES細胞周期阻滯在G2/M期[35].EVO在He La細胞內誘導DNA的寡核小體片段化, 在體外激活caspase-3, 并通過(guò)上調Bax/Bcl-2的比率促進(jìn)細胞的凋亡[36].EVO作用于人黑色素瘤A375-S2細胞, 激活caspase-3, 增強Fas-L表達和促使Bcl-2裂解, 這些信號可通過(guò)泛素-蛋白酶途徑增強[37].
在鼻咽癌、結直腸癌細胞系中, 多為抑制細胞遷移作用。EVO通過(guò)抑制p65亞基的移位可同時(shí)降低MMP-2的m RNA和蛋白質(zhì)水平及其在人鼻咽癌NPC細胞中的活性, 同時(shí)強烈減弱ERK1/2磷酸化水平, 抑制癌細胞的遷移和侵襲[38].EVO通過(guò)調節p53信號通路誘導人結直腸癌HCT-116細胞凋亡, 也可通過(guò)下調胃蛋白酶原I抑制JAK2/STAT3通路減少MMP3的表達從而抑制細胞遷移[39].
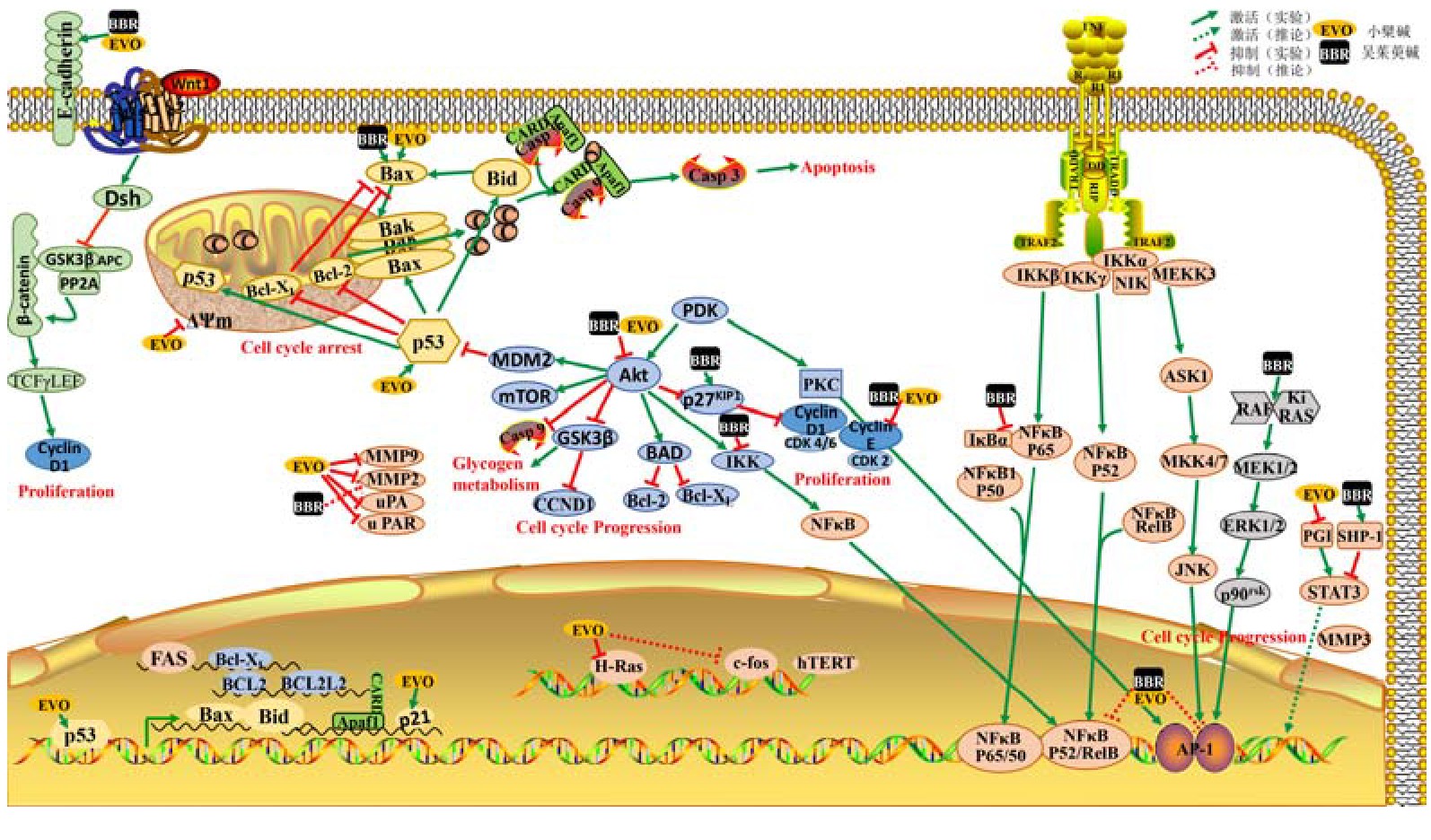
以上研究表明, EVO對胃癌、肝癌、乳腺癌、宮頸癌、人黑色素瘤、鼻咽癌、多發(fā)性骨髓瘤[40]、頭頸部鱗狀細胞癌[40]、白血病[40]、肺癌[41]、結腸癌[41]、大腸癌[42]等多種腫瘤細胞系都有抑制作用, 可作為腫瘤治療的潛在藥物。其作用機制主要體現在以下方面:通過(guò)抑制NF-κB激活、使Akt活性喪失抑制腫瘤細胞的增殖;激活caspase途徑抑制腫瘤細胞的增殖并誘導凋亡;降低基質(zhì)金屬蛋白酶的表達水平抑制腫瘤細胞的遷移與侵襲。
2.2 BBR的抗腫瘤作用
研究發(fā)現, BBR對多種腫瘤細胞系都存在藥理活性, 多表現為抑制細胞增殖、誘導凋亡等。
在肝癌、黑色素瘤細胞系中, 抑制細胞增殖作用較明顯。Wang等[43]證實(shí)了BBR可以抗肝癌SMMC-7721細胞增殖, 將細胞阻滯在G0/G1期, 其機制可能是線(xiàn)粒體膜電位下降, 激活caspase3信號通路所致。低濃度的BBR集中在線(xiàn)粒體中, 將細胞周期阻滯在G1期;高濃度的BBR則作用于細胞質(zhì)中, 將細胞周期阻滯在G2期, 并抑制DNA的合成, 從而抑制黑色素瘤細胞增殖[44].
在膀胱癌、胃癌、乳腺癌細胞系中, 誘導凋亡作用居多。BBR將人膀胱癌BIU-87和T24細胞周期阻滯在G1期;抑制原癌基因H-Ras及其下游基因c-fos的m RNA和蛋白質(zhì)的表達, 通過(guò)激活caspase-3和caspase-9誘導腫瘤細胞凋亡[45].通過(guò)上調Bax/Bcl-2比率和野生型p53基因表達, BBR可以抑制人胃癌AGS[46]、SNU-5[47]細胞增殖, 并誘導其凋亡。BBR通過(guò)抑制COX-2作用和存活素表達水平, 誘導人類(lèi)導管乳腺上皮腫瘤T47D細胞凋亡[48].BBR將MCF-7細胞周期阻滯在G0/G1期[50], 并通過(guò)增加細胞質(zhì)細胞色素c、caspase-9活性和PARP切割水平, 降低Bcl-2水平誘導凋亡[49].BBR可通過(guò)抑制組織纖溶酶原激活物誘導的MMP-1和MMP-9 m RNA和其蛋白表達, 從而抑制人乳腺癌轉移[51].
綜上, BBR對肝癌、膀胱癌、胃癌、乳腺癌、淋巴瘤[52]、卵巢癌[53]等腫瘤細胞系都有藥理活性。其作用機制主要體現在激活TNF誘導反應, 抑制NF-κB激活, 使Akt活性喪失, 破壞糖酵解過(guò)程等抑制腫瘤細胞增殖;激活caspase途徑抑制腫瘤細胞增殖并誘導凋亡;上調Bax/Bcl-2比率和野生型p53基因表達誘導細胞凋亡;抑制MMP-1、MMP-3和MMP-9的蛋白表達抑制細胞遷移。
2.3 BBR與EVO協(xié)同抗腫瘤作用
在肝癌細胞系中, EVO和BBR均可抑制Hep G2細胞的增殖, 其機制可能是抑制AP-1或抑制NF-κB信號通路從而將細胞周期阻滯在G2期, 抑制肝細胞增殖[27].當EVO和BBR聯(lián)合 (3:1) 使用時(shí), 對肝癌SMMC-7721細胞的抑制率高達50.00%, 抗腫瘤效果明顯強于單獨使用EVO 20.24%和BBR 16.33%的抑制率[54].馬超[29]先在細胞水平上確定了EVO與BBR兩者的劑量范圍及協(xié)同作用配比 (10:1) , 顯示兩者可協(xié)同抑制肝癌BEL-7402細胞增殖;而后在基因水平上采用RNA seq技術(shù)、基因富集和網(wǎng)絡(luò )整合等手段對兩者單獨及聯(lián)合作用于腫瘤細胞的差異基因進(jìn)行圖譜分析, 發(fā)現與其協(xié)同抑制腫瘤細胞增殖相關(guān)的差異表達基因有FZDl、GSK3B、CCNDl、GLIl、SOSl和AKT3.結果表明, 兩者合用可通過(guò)下調NF-κB和AP-1基因表達, 從而調節細胞增殖或凋亡基因 (CCNDl和Bcl-XL) 的表達, 也可下調BCL2和BCL2L2基因表達從而抑制癌細胞增殖或促進(jìn)細胞凋亡。同時(shí), 推測EVO與BBR可能通過(guò)調節不同micro RNA的表達致使某些特異性m RNA翻譯活性改變, 從而達到一定的協(xié)同效果。
在胃癌細胞系中, EVO對胃癌AGS細胞表現出抗增殖和抗遷移作用, 并有增加白細胞介素-8 (interleukin-8, IL-8) 表達和AGS細胞對內皮細胞的粘附能力的潛在傾向, 但在聯(lián)合BBR治療后抑制了其副作用。即IL-8被中和后, 由EVO誘導的增加AGS細胞粘附于人臍靜脈內皮細胞作用被廢除, 同時(shí)仍保持EVO抗腫瘤細胞增殖和抗遷移能力, 減少了胃癌細胞遷移或轉移的風(fēng)險[55].
在乳腺癌細胞系中, 吳焱等[56]驗證了EVO與BBR聯(lián)用能協(xié)同抑制人乳腺癌MDA-MB-231細胞遷移, 可減少BBR的不良反應, 仍保持抗遷移的作用。Liu等[57]發(fā)現BBR和EVO可以反轉大腸癌中被上調的mi R-429, 并增加鈣黏蛋白和Par3的量, 抑制腫瘤細胞分化與遷移, 從而達到治療癌癥的目的。
目前的研究結果顯示, EVO與BBR在治療機制上, 具有一定的相似性, 都可激活caspase途徑誘導腫瘤細胞凋亡, 推測其也可通過(guò)抑制AP-1或NF-κB信號通路發(fā)揮作用。EVO與BBR合用, 比例為3:1時(shí)對肝癌細胞有協(xié)同作用, 抑制腫瘤細胞增殖;比例為10:1時(shí)表達差異基因, 可能為其協(xié)同作用結果;EVO聯(lián)合BBR治療胃癌、乳腺癌時(shí), 可抵抗由EVO引起的副作用, 仍保持抗增殖和抗遷移作用;兩者合用治療大腸癌時(shí), 可下調mi R-429抑制腫瘤細胞遷移。EVO與BBR的抗腫瘤作用呈現出多靶點(diǎn)、多通路的特點(diǎn), 尚有不明確的作用機制和靶點(diǎn)需要進(jìn)一步研究。
3 連萸藥對及其主要成分的臨床應用
隨著(zhù)對連萸藥對及其主要成分BBR和EVO在分子、細胞及動(dòng)物水平的抗腫瘤作用研究的不斷深入, 其與腫瘤治療相關(guān)的臨床研究報道逐步涌現出來(lái)。2016年張曉亮[58]的團隊發(fā)現, 鹽酸小檗堿單用或是聯(lián)用扶正祛毒方治療乳腺癌均有明顯效果, 且聯(lián)用效果優(yōu)于單用;同年劉秀珍[59]的團隊也發(fā)現, 鹽酸小檗堿聯(lián)用人參莖葉皂苷能明顯提高患者的五年生存率, 降低乳癌手術(shù)復發(fā)及轉移的概率, 并能提高乳癌患者術(shù)后生存質(zhì)量, 與常規西藥化療相比無(wú)明顯副反應。相關(guān)臨床研究還有2001年由美國紀念斯隆-凱特林癌癥中心發(fā)起的采用黃連提取物治療實(shí)體腫瘤的I期臨床試驗以及尚未進(jìn)行的另一項研究小檗堿治療結直腸癌的II/III期臨床試驗[60].以上研究一方面證明了BBR抗腫瘤作用的臨床應用前景以及與其他中藥聯(lián)合應用協(xié)同治療腫瘤的潛在臨床價(jià)值, 另一方面也表明連萸藥對及其單體藥最終應用于腫瘤的臨床治療尚須開(kāi)展更多的臨床研究。
4 討論與展望
連萸藥對及其主要成分BBR和EVO的抗腫瘤作用在分子、細胞及動(dòng)物水平均有闡釋?zhuān)?主要涉及抗腫瘤細胞增殖、誘導凋亡與抑制遷移和侵襲三個(gè)方面。 (1) 藥對及兩個(gè)單體都能調控NF-κB或AP-1通路;BBR與EVO參與調節PI3K-AKT通路;BBR還可參與激活Raf-1蛋白激酶發(fā)揮作用。在A(yíng)kt受到抑制時(shí)激活GSK-3觸發(fā)細胞凋亡, 但這一過(guò)程中GSK-3參與癌基因轉化的機制仍然不清楚。 (2) 藥對及BBR、EVO主要調控死亡受體和線(xiàn)粒體/細胞色素c介導的凋亡通路誘導細胞凋亡。 (3) EVO與BBR均可增加鈣黏蛋白的表達, 減少MMP的表達, 抑制腫瘤細胞的遷移和侵襲;間接抑制新生血管的生成, 阻止腫瘤的轉移。
綜上, EVO與BBR治療腫瘤的具體機制可歸納為如圖1所示。圖1表明其作用機制具有多靶點(diǎn)、多通路的特點(diǎn), 各通路間相互銜接, 互相作用, 搭建起腫瘤治療通路網(wǎng)絡(luò )中的一部分。由圖可見(jiàn), EVO和BBR配伍抑制Akt激活, 抑制腫瘤細胞增殖;同時(shí)Akt靶點(diǎn)下游信號GSK3β也可以調節糖代謝功能[61-63], 可能為2型糖尿病的潛在靶點(diǎn), 與Wnt1通路也有一定聯(lián)系。但EVO和BBR配伍, 其相關(guān)變化機制仍然有不明確的地方, 還需要進(jìn)一步的基礎研究, 為臨床應用提供參考依據。
參考文獻
[1]國家藥典編輯委員會(huì )。中華人民共和國藥典:2015年版一部[S].北京:中國醫藥科技出版社, 2015.
[2]陳銳娥, 胡楊洋, 王勝鵬, 等。中藥藥對的系統研究 (Ⅳ) --黃連吳茱萸藥對研究[J].世界科學(xué)技術(shù) (中醫藥現代化) , 2012, 14 (2) :1334-1341.
[3]王林艷, 唐于平, 劉欣, 等。藥對研究 (Ⅵ) --黃連-吳茱萸藥對[J].中國中藥雜志, 2013, 38 (24) :4214-4219.
[4]Wang H, Mu W, Shang H, et al.The antihyperglycemic effects of Rhizoma Coptidis and mechanism of actions:a review of systematic reviews and pharmacological research[J].Biomed Res Int, 2014, 2014:798093.
[5]Tan HL, Chan KG, Pusparajah P, et al.Rhizoma Coptidis:a potential cardiovascular protective agent[J].Front Pharmacol, 2016, 7:362.
[6]Hu Y, Ehli EA, Hudziak JJ, et al.Berberine and evodiamine influence serotonin transporter (5-HTT) expression via the 5-HTT-linked polymorphic region[J].Pharmacogenomics J, 2012, 12 (5) :372-378.
[7]Tang J, Feng Y, Tsao S, et al.Berberine and Coptidis Rhizoma as novel antineoplastic agents:a review of traditional use and biomedical investigations[J].J Ethnopharmacol, 2009, 126 (1) :5-17.
[8]Hu Y, Fahmy H, Zjawiony JK, et al.Inhibitory effect and transcriptional impact of berberine and evodiamine on human white preadipocyte differentiation[J].Fitoterapia, 2010, 81 (4) :259-268.